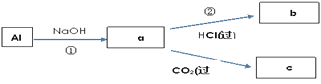
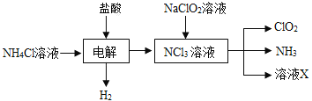
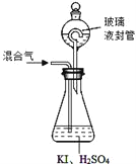
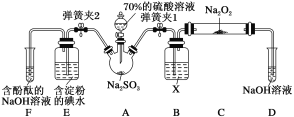
题目内容
【题目】在恒温、恒容密闭容器中,进行反应COS(g)+H2(g) H2S(g)+CO(g)。下列说法中能说明反应已达到平衡状态的是:
A. c(COS)保持不变B. c(H2S)=c(H2)
C. 容器中气体密度保持不变D. v(H2)=v(H2S)
【答案】A
【解析】
A. 对于一个化学反应,各组分的浓度不再发生改变,说明已达到平衡状态,A正确;
B. 反应物和生成物的浓度是否相等,取决于初始投料和反应的转化率,无法用来判定反应是否达到平衡状态,B错误;
C. 根据质量守恒定律,反应前后气体的质量不会发生改变,因为在恒容容器中进行,反应前后气体体积也不会发生变化,由公式![]() ,反应前后密度不会发生改变,故无法用来判定反应是否达到平衡状态,C错误;
,反应前后密度不会发生改变,故无法用来判定反应是否达到平衡状态,C错误;
D. 根据化学反应速率之比等于化学计量数之比,v(H2)=v(H2S),故无法用来判定反应是否达到平衡状态,D错误;
故答案选A。

【题目】资料显示“强酸性或强碱性溶液可使品红溶液褪色”。某兴趣小组探究SO2使品红溶液褪色的原因,实验如下。
Ⅰ.探究体现漂白性的主要微粒
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中。观察到前者褪色而后者不褪色。
实验二:
| 试管中的液体 | 现象 |
a.0.1mol/L SO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
d.pH=10 NaOH溶液 | 红色溶液不变色 | |
e.pH=2 H2SO4溶液 | 红色溶液不变色 |
(1)SO2水溶液中含![]() 的微粒有___。
的微粒有___。
(2)解释NaHSO3溶液显酸性的原因是___。
(3)实验d的目的是___。
(4)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是___。
Ⅱ.探究褪色过程的可逆性
甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变。
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红。
(5)实验方案合理的是___(选填“甲”或“乙”)。结合离子方程式说明其原因是___。
(6)丙同学利用SO2的还原性设计并完成了下列实验:向a实验后的无色溶液中滴入过量___(填编号),使溶液最终恢复红色。也得出结论:该褪色过程是可逆的。
A.稀硝酸 B.氯水 C.双氧水