题目内容
【题目】某冶金厂的炉渣中主要成分为CuO、Cu、Ag、Bi、Pb,还含有少量的SiO2和Au,从炉渣中回收有价金属的一种工艺流程如下:
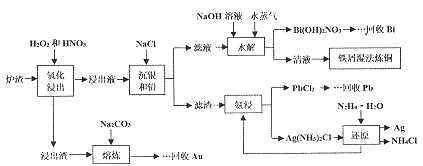
回答下列问题:
(1)加快“氧化浸出”速率的措施有________________。 (写出两种)。
(2)加入NaOH溶液的目的是调节滤液的pH,水解时通入水蒸气的目的是________。
(3)温法炼铜后溶液中主要的物质有(写化学式)____________。
(4)氨浸实验时,需要在常温下进行的原因是_________;熔炼时加入Na2CO3的目的是除硅,写出反应方程式____________。
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+):c(Ag+)=103时,溶液中的c(C1-)=______mol/L。
(6)写出流程中还原制银的化学方程式____________________。
【答案】 搅拌、废渣粉碎或其它合理答案 加快水解速率,促进Bi3+的水解 Fe(NO3)2、NaNO3 温度高,氨气易挥发 SiO2+Na2CO3![]() Na2SiO3+CO2↑ 100 4Ag(NH3)2Cl+N2H4·H2O=4Ag↓+N2↑+4NH3↑+4NH4Cl+H2O或4Ag(NH3)2Cl+N2H4=4Ag↓+N2↑+4NH3↑+4NH4Cl或4Ag(NH3)2Cl+N2H4·H2O+3H2O=4Ag↓+N2↑+4NH3·H2O+4NH4Cl
Na2SiO3+CO2↑ 100 4Ag(NH3)2Cl+N2H4·H2O=4Ag↓+N2↑+4NH3↑+4NH4Cl+H2O或4Ag(NH3)2Cl+N2H4=4Ag↓+N2↑+4NH3↑+4NH4Cl或4Ag(NH3)2Cl+N2H4·H2O+3H2O=4Ag↓+N2↑+4NH3·H2O+4NH4Cl
【解析】(1)加快固体炉渣溶解、提高反应速率的常用的措施有搅拌、粉碎、适当加热等;
(2)水解时通入水蒸气能适当提高温度,促进Bi3+的水解,有利于分离Cu2+ 和Bi3+;
(3)用铁屑温法炼铜的化学方程式为Cu(NO3)2+Fe=Fe(NO3)2+Cu,因此溶液中的主要物质有Fe(NO3)2、NaNO3;
(4)防止温度过高,氨水大量挥发或分解;在高温下熔炼时,加入的Na2CO3可与SiO2反应,化学方程式为SiO2+Na2CO3 ![]() Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
(5)设溶液中的c (C1-)为x,则AgCl沉淀时需要的c(Ag+)= ![]() ,PbCl2沉淀时需要的c(Pb2+ ) =
,PbCl2沉淀时需要的c(Pb2+ ) = ![]() ,当c(Pb2+):c(Ag+)=103时,求得x= 100 mol/L
,当c(Pb2+):c(Ag+)=103时,求得x= 100 mol/L
(6)流程中还原制银时,Ag+化合价降低生成Ag,则只有N2H4·H2O中-2价的N元素化合价升高生成N2,结合生成物NH4Cl,根据电子转移守恒和质量守恒可写出反应的化学方程式为4Ag(NH3)2Cl+N2H4·H2O=4Ag↓+N2↑+4NH3↑+4NH4Cl+H2O。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案