题目内容
14.下列叙述正确的是( )‘| A. | NH3是极性分子,N原子处在3个H原子所组成的三角形的中心 | |
| B. | CCl4性是非极性分子,C原子处在4个Cl原子所组成的正方形的中心 | |
| C. | H2O是极性分子,O原子不处在2个H原子所连成的直线的中央 | |
| D. | CO2是非极性分子,C原子不处在2个O原子所连成的直线的中央 |
分析 根据价层电子对互斥理论确定微粒空间构型和中心原子杂化方式的判断,正负电荷重心重合的分子是非极性分子,正负电荷重心不重合的是极性分子.
解答 解:A.N与3个H原子形成δ键,孤对电子数为$\frac{5-3}{2}$=1,所以N原子采用sp3杂化,为三角锥形分子,该分子正负电荷重心不重合,为极性分子,分子空间构型错误,故A错误;
B.CCl4中C与4个Cl形成4个δ键,孤对电子数为0,所以C原子采用sp3杂化,为正四面体结构,该分子正负电荷重心重合,为非极性分子,分子空间构型错误,故B错误;
C.H2O中O与2个H形成δ键,孤对电子数为$\frac{6-2}{2}$=2,所以O原子采用sp3杂化,为V形分子,该分子正负电荷重心不重合,为极性分子,分子空间构型也正确,故C正确;
D.CO2中C与2个O形成δ键,孤对电子数为$\frac{4-2×2}{2}$=0,所以C原子采用sp杂化,为直线形分子,该分子正负电荷重心重合,为非极性分子,故D错误;
故选C.
点评 本题考查了分子的空间构型、分子极性的判断,根据价层电子对互斥理论及正负电荷重心是否重合来分析解答即可,注意把握δ键数以及孤对电子数目判断,题目难度中等.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
4.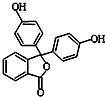 酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
 酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )| A. | 所有原子可能共平面 | |
| B. | 核磁共振氢谱中有7个峰 | |
| C. | 能发生加聚反应生成高分子化合物 | |
| D. | 1 mol该物质最多能与含4molNaOH的烧碱溶液反应 |
5.设NA代表阿伏加德罗常数.下面说法不正确的是( )
| A. | 17g氨气所含有的核外电子数是10NA | |
| B. | 7.1g氯气变成氯离子时得到的电子数是0.2NA | |
| C. | 标准状况下,11.2L水含有的氧原子数是0.5 NA | |
| D. | 同温同压下,NA个氢分子和NA个氮分子所占体积相同 |
9.下面实验操作可以实现实验目的是( )
| A. | 将SO2通入KMnO4溶液中,溶液褪色,证明SO2具有漂白性 | |
| B. | 取样灼烧,可以鉴别某白色纺织品是棉织品还是羊毛制品 | |
| C. | 动物油中主要成分是不饱和高级脂肪酸甘油酯 | |
| D. | 取少量蔗糖溶液加稀硫酸,水浴加入几分钟后,再加入新制的氢氧化铜悬浊液并加热,观察现象,判断蔗糖水解产物中是否有葡萄糖 |
19.在 中,处于同一平面内的原子最多有( )
中,处于同一平面内的原子最多有( )
 中,处于同一平面内的原子最多有( )
中,处于同一平面内的原子最多有( )| A. | 16个 | B. | 17个 | C. | 18个 | D. | 19个 |
6.在恒温、恒容条件下,能使A(g)+B(g)?C(g)+D(g)正反应速率增大的措施是( )
| A. | 减小C或D的浓度 | B. | 充入“惰性气体” | C. | 减小B的浓度 | D. | 升高温度 |
3.自来水厂常用某些含铝或含铁的化合物作净水剂,它们能净水的原理是( )
| A. | 和水中的杂质反应,生成沉淀 | |
| B. | Al3+和Fe3+都有吸附杂质使之沉淀的能力 | |
| C. | 使杂质变成泡沫而除去 | |
| D. | 生成氢氧化铝、氢氧化铁胶体,吸附水中杂质使之沉淀 |
4.下列说法正确的是( )
| A. | 1 mol的 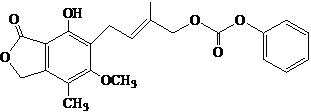 最多能与含5.0 mol NaOH的水溶液完全反应 最多能与含5.0 mol NaOH的水溶液完全反应 | |
| B. | 常压下,邻二甲苯、间二甲苯、对二甲苯的沸点依次增大 | |
| C. | 肌醇  与葡萄糖 与葡萄糖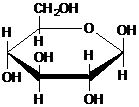 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | C3H8的所有碳原子一定在同一平面上 |
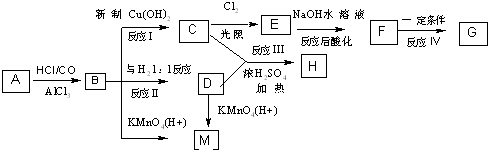
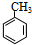 、M
、M ;
; ;C+D→H:
;C+D→H: .
.