题目内容
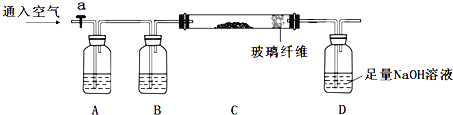
【题目】低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳循环正成为科学家研究 的主要课题。最近有科学家提出构想:把空气吹 入饱和碳酸钾溶液,然后再把CO2从溶液中提取 出来,经化学反应后使之变为可再生燃料甲醇。 该构想技术流程如下:
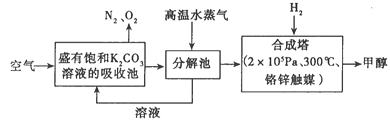
(1)向分解池中通入高温水蒸气的作用是________________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______________。
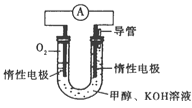
(3)依据甲醇燃烧的反应原理。设计如右图所示的电池装置。该装置负极的电极反应式为____________。
(4)已知Ksp(CaCO3)=2.8×10-9mol2·L-2.现将CaCl2溶液与0.02 mol·L-1Na2CO3溶液等体积混合,生成CaCO3沉淀时,所需CaCl2溶液的最小物质的量浓度为_____________。
(5)CO(g)和H2O(g)在一定条件下反应可得到清洁燃料H2。将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中发生反应:CO(g)+H2O(g)=CO2(g)+H2(g),不同温度下得到三组数据:
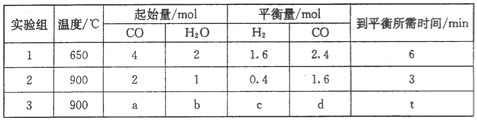
①实验1前6 min的反应速率v(CO2)=___________(保留小数点后两位,下同)。
②实验2条件下平衡常数K=_____________。
③该反应的△H____________0 (填“<”或“>”=。)
④实验3中,若平衡时的转化率α(CO)>α(H2O),则a/b的取值范围是_______________。
【答案】(1)提供高温环境使KHCO3分解;
(2)CH3OH(l)+O2(g)=CO(g)+4H2O(l) △H=-442.8kJ/mol;
(3)CH3OH-6e-+8OH-=CO32-+6H2O;(4)5.6×10-7mol/L;
(5)①0.13mol/(L·min)②0.17③<④![]()
【解析】
试题分析:(1)KHCO3受热易分解,向分解池中通入高温水蒸气,提供高温环境使KHCO3分解;
(2)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
依据盖斯定律(①-②+③×4)/2即可得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+4H2O(l) △H=-442.8kJ/mol;
(3)甲醇燃烧的反应原理,设计如图所示的电池装置,甲醇在负极失电子发生氧化反应,电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
(4)Na2CO3溶液的浓度为0.02mol/L,等体积混合后溶液中c(CO32-)=0.5×0.02mol/L=0.01mol/L,根据Ksp=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=2.8×109/0.01mol/L=2.8×10-7mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-7mol/L=5.6×10-7mol/L;
(5)①v(CO2)=v(CO)=![]() =0.13 mol/(L.min);
=0.13 mol/(L.min);
②实验2中达到平衡时,c(CO2)=c(H2)=0.4mol÷2L=0.2mol/L,c(CO)=1.6mol÷2L=0.8mol/L,c(H2O)=(1mol0.4mol)÷2L=0.3mol/L,K=(0.2×0.2)/(0.8×0.3)≈0.17;
③根据CO(g)+H2O(g)![]() CO2(g)+H2(g)可知压强对平衡移动无影响,如果在650℃,H2O、CO的物质的量改为1mol、2mol,达到平衡时CO的物质的量应为1.2mol,而900℃时CO的物质的量应为1.6mol,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0;
CO2(g)+H2(g)可知压强对平衡移动无影响,如果在650℃,H2O、CO的物质的量改为1mol、2mol,达到平衡时CO的物质的量应为1.2mol,而900℃时CO的物质的量应为1.6mol,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0;
④由于CO与H2O的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2O的转化率,则增大H2O的物质的量,即a/b的值小于1,所以a/b的取值范围是0<a/b<1。