题目内容
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
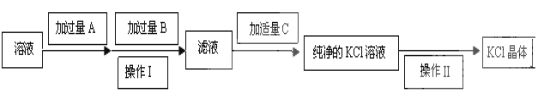
(1)写出上述试剂的化学式:A_____________________。
(2)上述操作Ⅰ所用玻璃仪器的名称是__________________;操作Ⅱ的名称是_____________。
(3)加过量A时发生有关反应的离子反应方程式为:_________________、__________________。
(4)检验试剂B是否过量的方法:__________________
【答案】Ba(OH)2 烧杯、玻璃棒、漏斗 蒸发结晶 Mg2++2OH-=Mg(OH)2 ↓ Mg2++SO42-+2OH-+Ba2+ =Mg(OH)2 ↓+ BaSO4 ↓ 静置,继续向溶液中加入K2CO3溶液,若无沉淀产生,则试剂B即K2CO3溶液过量
【解析】
向含有少量MgCl2、MgSO4杂质的KCl溶液中加入过量Ba(OH)2溶液,杂质离子反应形成Mg(OH)2、BaSO4沉淀,然后过滤除去杂质,向滤液中加入过量K2CO3,过量Ba(OH)2杂质会形成BaCO3沉淀,通过过滤除去,再向滤液中加入适量稀HCl,除去过量K2CO3溶液,得到纯净KCl溶液,最后通过蒸发结晶就得到KCl晶体。
根据上述分析可知试剂A是Ba(OH)2,试剂B是K2CO3,试剂C是HCl,操作I是过滤,操作II是蒸发结晶。
(1)试剂A是Ba(OH)2;
(2)上述操作Ⅰ是过滤,所用玻璃仪器有烧杯、玻璃棒、漏斗;操作Ⅱ的名称是蒸发结晶;
(3)向含有杂质MgCl2、MgSO4的KCl溶液中加入过量Ba(OH)2溶液,MgCl2与Ba(OH)2反应产生Mg(OH)2沉淀和K2SO4,离子方程式为:Mg2++2OH-=Mg(OH)2 ↓;MgSO4与Ba(OH)2反应产生Mg(OH)2沉淀和BaSO4沉淀,反应的离子反应方程式为:Mg2++SO42-+2OH-+Ba2+ =Mg(OH)2 ↓+ BaSO4 ↓;
(4)试剂B是K2CO3,若试剂B过量,则上层清液中不含有Ba2+。所以检验试剂B是否过量的方法是:静置,继续向溶液中加入K2CO3溶液,若无沉淀产生,则证明K2CO3溶液过量。

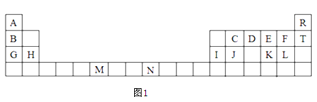
【题目】前四周期主族元素X、Y、M、N的信息如下:
有关信息 | |
X | X元素的原子最外层电子数是电子层数的3倍 |
Y | Y元素所在主族序数与周期序数之差为4,Y是同周期中原子半径最小的元素 |
M | 常温下单质呈液态的非金属元素 |
N | N的化合物在灼烧时焰色呈黄色 |
请回答下列问题:
(1)M元素在周期表中的位置______________________。
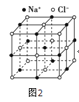
(2)Y元素的简单阴离子结构示意图_______________。
(3)化合物N2X2的电子式为_______________,试写出它的一种用途_______________。
(4)设计方案证明M、Y元素的得电子能力强弱:______________________________________。
(5)Y的单质是一种重要的化工原料,在工农业生产、生活中有着重要的应用。为探究Y单质的性质,某同学设计了如图所示的实验装置。
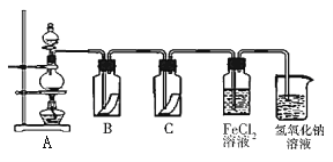
①实验中制取气体的化学方程式为:__________________________________________,该反应中氧化剂和还原剂的物质的量之比为_________________________
②装置B、C中依次放的是干燥的红色布条和湿润的红色布条,理论上装置_____中的红色布条褪色,但实验过程中该同学发现装置B、C中的布条均褪色,其原因可能是_________________。
③写出该气体与FeCl2溶液反应的离子方程式____________________________________。
④工业上常用石灰乳吸收制该气体制得漂白粉,漂白粉的必须密封保存,否则易失效,原因是____(用化学方程式表示)。
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |