题目内容
目前,聚氯乙烯塑料(PVC)占塑料消费量的30%以上,BICM法用乙烯、氯气等为原料合成PVC,其工艺流程如下.
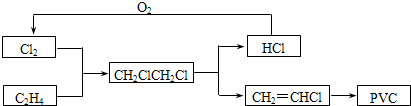
(1)一定条件下,HCl与O2反应可以制取Cl2,其热化学反应方程式为:
4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H<0.
降低温度,该反应的化学平衡常数K会 .
A.增大 B.减小 C.不变 D.无法确定
(2)一定温度下某体积可变的容器中充入2LHCl气体和3L空气(氧气占
),充分反应后气体体积为4.6L.该反应中HCl气体的转化率为 .
(3)假设BICM法中各步反应的转化率均为100%,计算生产200吨PVC需要购得的氯气质量为 .

(1)一定条件下,HCl与O2反应可以制取Cl2,其热化学反应方程式为:
4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H<0.
降低温度,该反应的化学平衡常数K会
A.增大 B.减小 C.不变 D.无法确定
(2)一定温度下某体积可变的容器中充入2LHCl气体和3L空气(氧气占
| 1 |
| 5 |
(3)假设BICM法中各步反应的转化率均为100%,计算生产200吨PVC需要购得的氯气质量为
考点:化学平衡常数的含义,化学平衡的计算
专题:化学平衡专题
分析:(1)该反应正反应是放热反应,降低温度,平衡向正反应移动,平衡常数增大;
(2)充分反应后气体体积变化为3L+2L-4.6L=0.4L,利用差量法计算计算参加反应的HCl的体积,再根据转化率定义计算;
(3)PVC是聚氯乙烯,其质量等于氯乙烯的质量,氯元素被完全利用生成氯乙烯,氯乙烯中氯元素的质量等于需要氯气的质量,根据氯乙烯中氯元素的质量分数计算需要氯气的质量.
(2)充分反应后气体体积变化为3L+2L-4.6L=0.4L,利用差量法计算计算参加反应的HCl的体积,再根据转化率定义计算;
(3)PVC是聚氯乙烯,其质量等于氯乙烯的质量,氯元素被完全利用生成氯乙烯,氯乙烯中氯元素的质量等于需要氯气的质量,根据氯乙烯中氯元素的质量分数计算需要氯气的质量.
解答:
解:(1)该反应正反应是放热反应,降低温度,平衡向正反应移动,平衡常数增大,故答案为:A;
(2)充分反应后气体体积变化为3L+2L-4.6L=0.4L,
4HCl(g)+O2(g)?2Cl2(g)+2H2O(g) 体积减少△V
4 1
V(HCl) 0.4L
故V(HCl)=0.4L×4=1.6L,
故HCl气体的转化率为
×100%=80%,
故答案为:80%;
(3)PVC是聚氯乙烯,其质量等于氯乙烯的质量,氯元素被完全利用生成氯乙烯,氯乙烯中氯元素的质量等于需要氯气的质量,故需要氯气的质量为200t×
=113.6t,
故答案为:113.6t.
(2)充分反应后气体体积变化为3L+2L-4.6L=0.4L,
4HCl(g)+O2(g)?2Cl2(g)+2H2O(g) 体积减少△V
4 1
V(HCl) 0.4L
故V(HCl)=0.4L×4=1.6L,
故HCl气体的转化率为
| 1.6L |
| 2L |
故答案为:80%;
(3)PVC是聚氯乙烯,其质量等于氯乙烯的质量,氯元素被完全利用生成氯乙烯,氯乙烯中氯元素的质量等于需要氯气的质量,故需要氯气的质量为200t×
| 35.5 |
| 24+3+35.5 |
故答案为:113.6t.
点评:本题考查化学平衡常数的影响因素、化学计算等,(3)中计算为易错点、难点,注意氯元素完全利用,根据氯元素守恒计算计算,注意守恒思想的运用.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,4.4g CO2和4.4g N2O的原子总数都是0.3NA |
| B、次氯酸光照分解产生22.4mL气体(标准状况下),转移电子数为0.002NA |
| C、常温下,4.6g乙醇含有C-H键总数为0.6 NA |
| D、0.2 mol?L-1FeCl3溶液中含有Cl-总数为0.6NA |
下列物质中,属于电解质的是( )
| A、CuSO4 |
| B、铁 |
| C、NaCl溶液 |
| D、CO2 |
在pH=1的溶液中,能大量共存的一组离子或分子是( )
| A、Mg2+、Na+、ClO-、NO3- |
| B、Al3+、NH4+、Br-、Cl- |
| C、K+、Cr2O72-、CH3CHO、SO42- |
| D、Na+、K+、SiO32-、Cl- |
下列反应的离子方程式不正确的是( )
| A、铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、氢氧化钠与盐酸反应:OH-+H+═H2O |
| C、锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu |
| D、氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A、106 g Na2CO3晶体中的离子总数大于3NA |
| B、在铜与硫的反应中,1 mol铜失去的电子数为2NA |
| C、在25℃时,压强为1.01×105帕时,11.2L氧气所含的原子数为NA |
| D、0.5mol铝与足量烧碱溶液反应,转移的电子数为1.5NA |
下列物质中S的化合价为+4的是( )
| A、S |
| B、SO2 |
| C、BaSO4 |
| D、H2SO4 |