题目内容
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法错误的是
| A.该反应的化学方程式为4NH3+3F2→ NF3+3NH4F |
| B.M是极性分子,其还原性比NH3强 |
| C.M既是氧化产物,又是还原产物 |
| D.N中既含有离子键,又含有共价键 |
B
解析试题分析:根据信息A正确;B.M:NF3是极性分子,由于氮氟键比较牢固不易断裂,其还原性没有NH3强,错误;C.M:NF3既是氧化产物,又是还原产物,正确;D.N中既含有离子键存在于铵根和氟离子间,又含有共价键存在于铵根内部,正确。
考点:考查氧化还原反应方程式的书写及化学键的判断等相关知识。

练习册系列答案
相关题目
将一定量氯气通入溴化亚铁溶液后,再加入四氯化碳,振荡,静置,整个过程中肯定能观察到的现象
| A.水层显棕黄色 | B.水层无色 | C.四氯化碳层显红棕色 | D.四氯化碳层无色 |
氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部分的是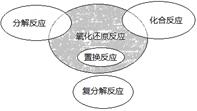
| A.4NH3 +5O2 =4NO+6 H2O |
| B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.2NaHCO3=Na2CO3+H2O+CO2↑ |
| D.Cl2+2NaBr=2NaCl +Br2 |
氮化铝(化学式为AlN,其中Al为+3价)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN 可通过反应:Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.Al2O3是氧化剂 | B.N2被氧化 |
| C.AlN的摩尔质量为41 g | D.生成1 mol AlN转移3 mol电子 |
把一定质量的铁完全溶解于某浓度的硝酸中收集到0.3 mol NO2和0.2 mol NO。向反应后的溶液中加入足量NaOH溶液充分反应,经过滤、洗涤后,把所得沉淀加热至质量不再减少为止。得到固体质量不可能为
| A.18 g | B.24 g | C.30 g | D.36 g |
关于反应CaO + 3C→CaC2 + CO,下面哪种表述能最好地说明该反应是一个氧化还原反应
| A.CaO失氧变为CaC2 |
| B.碳元素失去了电子,同时也得到了电子 |
| C.钙元素的化合价在反应前后发生了改变 |
| D.单质碳的状态发生了变化 |
根据表中信息判断,下列选项不正确的是
| 序号 | 反应物 | 产物 |
| ① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4 ...... |
| ② | Cl2 、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- ...... | Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比小于或等于1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
0.02 mol FeS2与一定浓度的硝酸完全反应,Fe元素和S元素全部转化为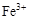 和
和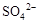 ,同
,同
时产生氮的氧化物(NO、NO2、N2O4)混合气体共0.25 mol,该混合气体的平均相对分子质量可能是
| A.30 | B.46 | C.50 | D.66 |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法正确的是( )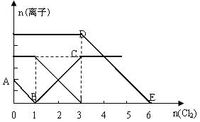
| A.还原性I->Fe2->Br- |
| B.原混合溶液中c(FeBr2) = 4mol/L |
| C.当通入Cl2 2mol时,溶液中已发生的离子反应可表示为:2Fe2+ + 2I- + 2Cl2 → 2Fe3+ + I2 + 4 Cl- |
| D.原溶液中n(Fe2+) :n(I-) :n(Br-) =" 2" :1 :3 |