题目内容
10.已知下列热化学方程式:①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
④C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
回答下列各问题:
(1)表示C的燃烧热的热化学方程式为④;(填序号)
(2)燃烧10g H2生成液态水,放出的热量为1429.0kJ.
(3)写出表示CO的燃烧热的热化学方程式CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1.
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,根据热化学方程式的意义来判断;
(2)根据热化学方程式系数的意义:代表物质的量的多少来回答;
(3)CO燃烧热是1mol可燃物CO完全燃烧生成稳定氧化物二氧化碳放出的热量,据此回答.
解答 解:(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,所以C的燃烧热的热化学方程式为④,故答案为:④;
(2)根据①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1,燃烧2g氢气生成液态水放热是285.8kJ,所以燃烧10gH2生成液态水,放出的热量为285.8kJ×5=1429.0kJ,故答案为:1429.0kJ;
(3)CO燃烧热是1mol可燃物CO完全燃烧生成稳定氧化物二氧化碳放出的热量,CO(g)+$\frac{1}{2}$O2(g)═CO2(g)可以是④-③得到,即CO(g)+$\frac{1}{2}$O2(g)═CO2(g))△H=(-393.5kJ•mol-1)-(-110.5kJ•mol-1)=-283.0kJ•mol-1,即CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1.
故答案为:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1.
点评 本题涉及燃烧热的含义以及热化学方程式的意义和盖斯定律的应用知识,属于综合知识的考查,难度不大.

练习册系列答案
相关题目
18.900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: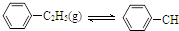 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
经一段时间后达到平衡.反应过程中测定的部分数据见下表:
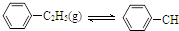 =CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )
=CH2(g)+H2(g)△H=a kJ•mol-1下列说法正确的是( )经一段时间后达到平衡.反应过程中测定的部分数据见下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50% | |
| B. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| C. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
15.已知苯跟一卤代烷在催化剂作用下可生成苯的同系物.如: 在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
 在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )| A. | CH3-CH3和Cl2 | B. | CH2=CH2和Cl2 | C. | CH2=CH2和HCl | D. | CH≡CH和Cl2 |
2.市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强.衣物上的汗渍、血迹及人体排放的蛋白质污渍遇到它,皆能水解而被除去.下列衣料中不能用加酶洗衣粉洗涤的是:①棉织品 ②蚕丝织品 ③毛织品( )
| A. | ① | B. | ②③ | C. | ①②③ | D. | ①③ |
19.许多物质都有俗称.以下物质的俗称与化学式不相符的是( )
| A. | 干冰CO2 | B. | 生石灰CaO | C. | 熟石灰Ca(OH)2 | D. | 纯碱NaOH |
20.下列说法正确的是( )
| A. | 凡是放热反应的发生均无需加热 | |
| B. | 凡是需要加热后才能发生的反应一定是吸热反应 | |
| C. | 伴有能量变化的物质变化都是化学变化 | |
| D. | 物质发生化学反应都伴随着能量变化 |
 实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
实验室制乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫. $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$ +HCl,下列是由苯制取有机物“茚”的反应过程:
+HCl,下列是由苯制取有机物“茚”的反应过程: $\stackrel{SOCl_{2}}{→}$
$\stackrel{SOCl_{2}}{→}$ $→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$
$→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$ $→_{④}^{浓H_{2}SO_{4}/△}$茚
$→_{④}^{浓H_{2}SO_{4}/△}$茚 、茚
、茚 ;
; 互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种)
互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种) .
. 有下列性质AD
有下列性质AD 的合成路线流程图(其他无机试剂任选).
的合成路线流程图(其他无机试剂任选).