题目内容
【题目】以天然气、焦炭、水为初始原料,可以制得CO和H2,进而人工合成汽油。(流程示意图如下,反应③的H2也由反应①得到。)
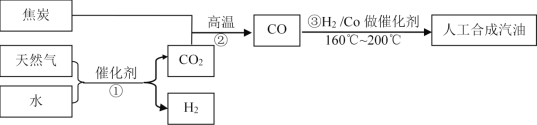
若反应①、②、③的转化率均为100%,且将反应①中得到的CO2和H2全部用于合成人工汽油。
(1)通过计算说明上述方案能否得到理想的产品_______________。
(2)当CO2的使用量应控制为反应①中CO2产量的______________(填比例范围),可以得到理想的产品。
【答案】不能得到理想产品 ![]()
【解析】
(1)合成汽油的方程式为:①nCO+(2n+1)H2![]() CnH2n+2+nH2O,汽油中C原子数在=5~8,此时
CnH2n+2+nH2O,汽油中C原子数在=5~8,此时![]() ;②CH4+2H2O
;②CH4+2H2O![]() CO2+4H2、CO2+C
CO2+4H2、CO2+C![]() 2CO可知,若反应第一个反应中CO2全部用于合成汽油,则
2CO可知,若反应第一个反应中CO2全部用于合成汽油,则![]() ,所以不能得到理想汽油;
,所以不能得到理想汽油;
(2)当n=5~8时,![]() ,根据CH4+2H2O
,根据CH4+2H2O![]() CO2+4H2、CO2+C
CO2+4H2、CO2+C![]() 2CO、nCO+(2n+1)H2
2CO、nCO+(2n+1)H2![]() CnH2n+2+nH2O可知,1 mol CO2能够生成2 mol CO,所以CO2的使用量应控制为反应CH4+2H2O
CnH2n+2+nH2O可知,1 mol CO2能够生成2 mol CO,所以CO2的使用量应控制为反应CH4+2H2O![]() CO2+4H2中CO2产量的
CO2+4H2中CO2产量的![]() ~
~![]() ,可以得到理想的产品。
,可以得到理想的产品。

 春雨教育同步作文系列答案
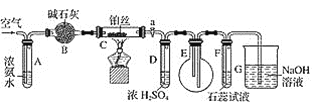
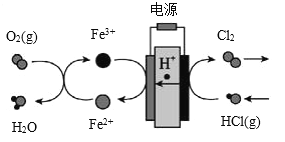
春雨教育同步作文系列答案【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=______________。
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①用H2表示前2 h 的平均反应速率v(H2)=_________________________________;
②该温度下,CO2的平衡转化率为________。
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①该反应的ΔH________0(填“>”或“<”)。
②曲线c表示的物质为_______。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施______________。(答出一条即可)