题目内容
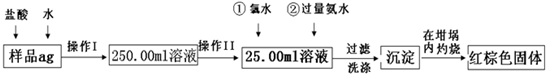
某氧化铁样品中含有少量的FeSO4杂质.某同学要测定其中铁元素的质量分 数,他设计了如下方案进行测定,操作流程为:
请根据流程回答:
(1)操作I中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,坯必 须有______(填仪器名称).
(2)操作II中必须用到的仪器是______
A.50ml 量筒 B.100ml 量筒 C.50ml酸式滴定管 D.50ml碱式滴定管
(3)反应①中,加入足量H2O2溶液反应的离子方程式______.
(4)检验沉淀中SO42-是否冼涤干净的操作______
(5)将沉淀物加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为hlg,再次加热 并冷却至室温称量其质量为hg,若b1-b2=0.3,还应进行的操作是______
(6)若坩埚的质量为42.6g,最终坩埚与加热后同体的总质量为45.8g,则样品中铁元素的 质量分数=______(保留一位小数).
(7)另一同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水后充分搅拌,加热蒸干灼烧称量即可,请你评价他的这个方案是否可行?______.(填“可行”或“不可行”)
解:(1)将样品和稀硫酸反应后的溶液配制成500mL溶液需要500mL容量瓶,
故答案为:500mL容量瓶;
(2)由于操作II是准确量取50.00mL的稀释后的显示酸性的溶液,所以应需要酸式滴定管,
故选C;
(3)由于加双氧水的目的就是让+2价铁变为+3价,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)沉淀洗涤就是把硫酸根离子或NH4+洗掉,可以检验洗涤液中是否含有氯离子,取少量最后一次洗涤液于试管中,滴加硝酸钡溶液,若无白色沉淀生成,则证明洗涤干净,
故答案为:取少量最后一次洗涤液于试管中,滴加硝酸钡溶液,若无白色沉淀生成,则证明洗涤干净;
(5)必须满足两次连续称量的质量相差不能超过0.1g,才能说明分解完全,故应继续加热并称量,直至两次连续称量质量差不超过0.1g,
故答案为:继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g;
(6)500mL溶液可以得到Fe2O3质量为10((45.8g-42.6g)g=32g,铁元素的质量为32g×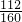 =22.4g,
=22.4g,
所以原氧化铁样品中铁元素的质量分数为: ×100%=80.0%,
×100%=80.0%,
故答案为:80.0%(或0.8);
(7)由于杂质是硫酸亚铁,加热蒸干灼烧,最后得到的还是硫酸铁和氧化铁的混合物,无法计算铁元素的质量分数,所以此方案不可行,
故答案为:不可行.
分析:本实验目的是测定铁的质量分数,采取的方法是使样品溶解、反应、最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数
(1)由图可知,操作I是将加入硫酸反应的溶液稀释成500.00mL溶液,故需要500mL的容量瓶;
(2)操作II是准确量取50.00mL的稀释后的酸溶液,故应需要酸式滴定管;
(3)加双氧水目的就是让+2价铁变为+3价;
(4)沉淀洗涤就是把硫酸根离子或NH4+洗掉,可以检验洗涤液中是否含有氯离子,取少量最后一次洗出液,滴加硝酸钡溶液,若无沉淀生成,则证明洗涤干净;
(5)两次连续称量的质量相差不能超过0.1g才能说明分解完全,故应继续加热并称量;
(6)加热分解所得的物质是Fe2O3,其质量为(45.8g-42.6g)g,由于去50mL溶液,故500mL溶液可以得到Fe2O3质量为10(45.8g-42.6g)g,根据化学式计算铁元素的质量,再利用质量分数的定义计算出原氧化铁样品中铁元素的质量分数;
(7)杂质是硫酸亚铁,加热蒸干灼烧,最后得到的还是硫酸铁和氧化铁的混合物,不是三氧化二铁,无法计算铁元素的质量分数.
点评:本题考查溶液配制、离子检验、对实验操作的理解与实验方案的评价、化学计算等,难度中等,清楚测定原理是解题的关键,是对所学知识的综合运用,需要学生具有扎实的基础与运用知识分析解决问题的能力.
故答案为:500mL容量瓶;
(2)由于操作II是准确量取50.00mL的稀释后的显示酸性的溶液,所以应需要酸式滴定管,
故选C;
(3)由于加双氧水的目的就是让+2价铁变为+3价,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)沉淀洗涤就是把硫酸根离子或NH4+洗掉,可以检验洗涤液中是否含有氯离子,取少量最后一次洗涤液于试管中,滴加硝酸钡溶液,若无白色沉淀生成,则证明洗涤干净,
故答案为:取少量最后一次洗涤液于试管中,滴加硝酸钡溶液,若无白色沉淀生成,则证明洗涤干净;
(5)必须满足两次连续称量的质量相差不能超过0.1g,才能说明分解完全,故应继续加热并称量,直至两次连续称量质量差不超过0.1g,
故答案为:继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g;
(6)500mL溶液可以得到Fe2O3质量为10((45.8g-42.6g)g=32g,铁元素的质量为32g×
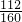 =22.4g,
=22.4g,所以原氧化铁样品中铁元素的质量分数为:
 ×100%=80.0%,
×100%=80.0%,故答案为:80.0%(或0.8);
(7)由于杂质是硫酸亚铁,加热蒸干灼烧,最后得到的还是硫酸铁和氧化铁的混合物,无法计算铁元素的质量分数,所以此方案不可行,
故答案为:不可行.
分析:本实验目的是测定铁的质量分数,采取的方法是使样品溶解、反应、最终生成氧化铁,然后通过氧化铁质量来求铁的质量分数
(1)由图可知,操作I是将加入硫酸反应的溶液稀释成500.00mL溶液,故需要500mL的容量瓶;
(2)操作II是准确量取50.00mL的稀释后的酸溶液,故应需要酸式滴定管;
(3)加双氧水目的就是让+2价铁变为+3价;
(4)沉淀洗涤就是把硫酸根离子或NH4+洗掉,可以检验洗涤液中是否含有氯离子,取少量最后一次洗出液,滴加硝酸钡溶液,若无沉淀生成,则证明洗涤干净;
(5)两次连续称量的质量相差不能超过0.1g才能说明分解完全,故应继续加热并称量;
(6)加热分解所得的物质是Fe2O3,其质量为(45.8g-42.6g)g,由于去50mL溶液,故500mL溶液可以得到Fe2O3质量为10(45.8g-42.6g)g,根据化学式计算铁元素的质量,再利用质量分数的定义计算出原氧化铁样品中铁元素的质量分数;
(7)杂质是硫酸亚铁,加热蒸干灼烧,最后得到的还是硫酸铁和氧化铁的混合物,不是三氧化二铁,无法计算铁元素的质量分数.
点评:本题考查溶液配制、离子检验、对实验操作的理解与实验方案的评价、化学计算等,难度中等,清楚测定原理是解题的关键,是对所学知识的综合运用,需要学生具有扎实的基础与运用知识分析解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(12分)某氧化铁样品中含有少量的FeCl2杂质。现要测定其中铁元素的质量分数,按以下步骤进行实验:
请根据图的流程,回答下列问题:
⑴操作I的目的为配制250.00ml样品溶液,则所用到玻璃仪器除烧杯、玻璃棒、胶头滴管以外,还必须有 (填仪器名称);操作II必须用到的仪器是 。(填字母)
| A.50ml烧杯 | B.50ml量筒 | C.100ml量筒 | D.25ml滴定管 |

⑵再加入氨水的离子方程式为 。
⑶检验沉淀是否洗涤干净的操作是
。
⑷将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1—b2=0.3,则接下来还应进行的操作是 。
⑸若坩埚的质量为W1g,坩埚与加热后固体的总质量为W2g,则样品中铁元素的质量分数是 。
⑹有学生认为上述实验步骤太繁琐,他认为,将样品溶于水后充分搅拌,在空气中加热蒸干燃烧称量即可,请你评价是否可行? 。(填“可行”或“不可行”)