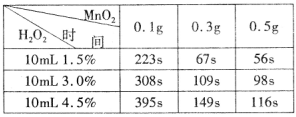
题目内容
下列有关溶液的叙述中,正确的是
| A.中和10 mL 0.1 mol·L-1醋酸与中和100 mL 0.01 mol·L-1的醋酸所需同种碱溶液的量不同 |
| B.常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7 |
| C.常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等 |
| D.常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等 |
D
解析试题分析:A、10 mL 0.1 mol·L-1醋酸与中和100 mL 0.01 mol·L-1的醋酸含有的CH3COOH物质的量相等,所以中和时所需同种碱溶液的量相等,错误;B、因为酸的强弱和碱的强弱不明确,所以常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH不确定,错误;C、常温下,体积相等、pH相同的盐酸和硫酸溶液,c(HCl)=2c(H2SO4),错误;D、常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等,都是0.001mol?L?1。
考点:本题考查酸碱中和反应、弱电解质的电离、pH的判断。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用水稀释0.1mol·L-1 氨水时,溶液中随着水量的增加而减小的是( )
A.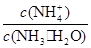 | B.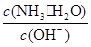 |
| C.c(H+)×c(OH-) | D.OH-的物质的量 |
已知常温下KHSO3溶液的pH<7,且等浓度的HSO3-的电离程度大于SO32-的水解程度。等物质的量的KHSO3、K2SO3、K2SO4溶于足量水形成的溶液中,有关粒子之间的关系正确的是
| A.c(SO42-)>c(HSO3-)>c(SO32-) >c(H2SO3) |
| B.c(K+)>c(SO32-)>c(SO42-)>c(HSO3-)>c(H+)>c(OH-) |
| C.c(K+)=c(HSO3-)+2c(SO32-)+2c(SO42-) |
| D.c(K+)+c(H+)=c(HSO3-)+c(SO32-)+c(SO42-)+c(OH-) |
下列说法正确的是
A.某温度时, 1LpH=6的水溶液,含 离子 离子 |
B.含10.6gNa2CO3溶液中,所含阴离子总数等于 |
| C.VLamol/LFeCl3溶液中,若Fe3+离子数目为1mol,则Cl-离子数目大于3mol。 |
D.电解精炼粗铜时,每转移 电子,阳极上溶解的 电子,阳极上溶解的 原子数必为 原子数必为 |
下图表示的是某物质所发生的( )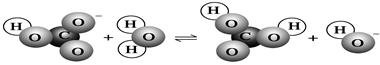
| A.取代反应 | B.水解反应 |
| C.中和反应 | D.电离过程 |
己知25℃时,Ksp(AgCl) =1.8×10-10,Ksp(AgBr) =5.4×10-13,Ksp(AgI) =8.5×10-17。某溶液中含有C1-、Br-和I-,浓度均为0.010mo1·L-1,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
| A.C1-、Br-、I- | B.Br-、C1-、I- |
| C.I-、Br-、C1- | D.Br-、I-、C1- |
T ℃时,某NaOH溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如表中所示:
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
A.3 B.4 C.5 D.6
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A.1.0mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B.1.0mol/LNH4Cl溶液:c(NH4+)=c(Cl-) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |