题目内容
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)![]() CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) △H=-393.5kJ?mol-1
H2(g)+![]() O2(g)=H2O(g) △H=-242.0kJ?mol-1
O2(g)=H2O(g) △H=-242.0kJ?mol-1
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ?mol-1
O2(g)=CO2(g) △H=-283.0kJ?mol-1
请回答:
(1)根据以上数据,写出C(s)与水蒸汽反应的热化学方程式:
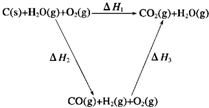
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和比1molC(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图:

并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是 (填“甲”或“乙”);判断的理由是
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇 ②甲醛 ③甲酸 ④乙酸。试分析当CO和H2按1:1的体积比混合反应,合成上述 (填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
(1)C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ?mol-1
(2)乙 甲同学忽略了煤转化为水煤气要吸收热量(或△H1=△H2+△H3且△H2>0)
(3)①减少污染 ②燃烧充分 ③方便 ④直接燃烧水煤气热量大
(4)②④

党的十七大报告指出:“加强能源资源节约和生态环境保护,增强可持续发展能力,坚持节约资源和保护环境的基本国策,发展环保产业.”
(1)下列有关做法不符合上述要求的是________.
| A.将煤液化、气化,提高燃料的燃烧效率 |
B.安装汽车尾气催化转化装置,使之反应:4CO+2NO2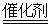 4CO2+N2 4CO2+N2 |
| C.大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃烧电池汽车 |
| D.在水力发电、火力发电、核能发电和风力发电中要大力发展火力发电 |
C(s)+H2O(g)
 CO(g)+H2(g);C(s)、H2(g)和CO(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、H2(g)和CO(g)完全燃烧的热化学方程式为:C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol ①
H2(g)+
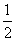 O2(g)===H2O(g) ΔH=-242.0 kJ/mol ②
O2(g)===H2O(g) ΔH=-242.0 kJ/mol ②CO(g)+
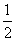 O2(g)===CO2(g) ΔH=-283.0 kJ/mol ③
O2(g)===CO2(g) ΔH=-283.0 kJ/mol ③请回答:
①根据以上数据,写出C(s)与H2O(g)反应的热化学方程式:_____________________________________.
②水煤气不仅是优良的气体燃料,也是重要的有机化工原料,CO和H2在一定条件下可以合成:a.甲醇;b.甲醛;c.甲酸;d.乙酸.试分析当CO和H2按1∶1的体积比混合反应,合成上述________(填序号)物质时,可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放.
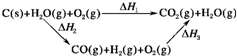
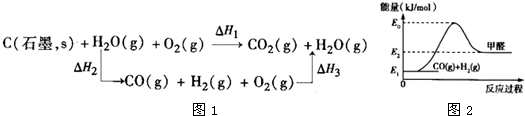
 4CO2+N2
4CO2+N2 CO(g)+H2(g);C(s)、H2(g)和CO(g)完全燃烧的热化学方程式为:
CO(g)+H2(g);C(s)、H2(g)和CO(g)完全燃烧的热化学方程式为: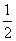 O2(g)===H2O(g) ΔH=-242.0 kJ/mol ②
O2(g)===H2O(g) ΔH=-242.0 kJ/mol ②