题目内容
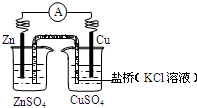
 铜锌原电池(如图)工作时,下列叙述正确的是( )
铜锌原电池(如图)工作时,下列叙述正确的是( )分析:铜锌原电池中,锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,铜为正极,发生Cu2++2e-=Cu,原电池工作时,电子从电池负极经外电路流向正极,以此解答该题.
解答:解:A.正极反应为Cu2++2e-=Cu,故A错误;
B.电池总反应为锌置换出铜,为Zn+Cu2+=Zn2++Cu,故B正确;
C.电子从电池负极经外电路流向正极,故C错误;
D.撤去盐桥,不能形成闭合回路,则不能形成原电池反应,故D错误.
故选B.
B.电池总反应为锌置换出铜,为Zn+Cu2+=Zn2++Cu,故B正确;
C.电子从电池负极经外电路流向正极,故C错误;
D.撤去盐桥,不能形成闭合回路,则不能形成原电池反应,故D错误.
故选B.
点评:本题考查原电池的工作原理,为高考常见题型,注意把握工作原理以及电极方程式的书写,题目难度中等.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
 铜锌原电池(如图)工作时,下列叙述正确的是( )
铜锌原电池(如图)工作时,下列叙述正确的是( )| A、外电路中,电子从锌棒经导线流向铜棒 | B、电池总反应为:Zn+2H+?Zn2++H2↑ | C、正极反应为:Zn-2e-?Zn2+ | D、盐桥中的K+移向ZnSO4溶液 |
 铜锌原电池(如图)工作时,下列叙述正确的是( )
铜锌原电池(如图)工作时,下列叙述正确的是( ) 铜锌原电池(如图)工作时,下列叙述不正确的是( )
铜锌原电池(如图)工作时,下列叙述不正确的是( )