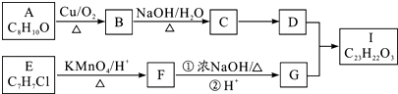
��Ŀ����
����Ŀ��2015��8��12�գ�������������ը�¹�ȷ�����軯�ơ��������Ƶȣ��軯�ƶ��Ժ�ǿ����ˮ���������ж���ȼ�軯�����壮�軯��ķе�ֻ��26�棬����൱���ӷ������������ʹ���������ж��ķ��գ�ͬʱ�軯�������������ƻᷢ����ը���ش���������
��1��д���軯����ˮ�����軯������ӷ���ʽ ��
��2����ը�ֳ�Լ700�ֵ��軯�ƴ�Լ��Ҫ900�ֵ�˫��ˮ���������軯����˫��ˮ�������ͷų�����ͬʱ������ɫ���壬ʹ���軯�ƵĶ��Դ�ͣ�д���軯����˫��ˮ��Ӧ�Ļ�ѧ����ʽ ��
��3����ը�����ڷ�ˮ�е�CN��������Cr2O72���������ⶨ�������̽��з�ˮ���� 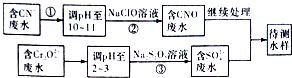
1������������ˮ��������Ҫʹ�õķ�������
a���� ���� b���кͷ� c�������� d��������ԭ��
2�����з�Ӧ��������ų����÷�Ӧ�����ӷ���ʽΪ��
3��������У�ÿ����0.4 molCr2O72��ʱת�Ƶ���2.4 mol���÷�Ӧ�����ӷ���ʽΪ��
4����������Cr2O72����ˮ������������巨���÷������ˮ�м���FeSO4 7H2O��Cr2O72����ԭ��Cr3+ �� ����pH��Fe��Crת�����൱��Fe��[Fex��Cr��2��x����]O4 ���������壬���Ͻǵ��������ֱ�ʾ��Ԫ�صĻ��ϼۣ��ij���������1 mol Cr2O72�� �� �����amol FeSO4 7H2O�����н�����ȷ���� ��
A��x=0.5��a=6 B��x=0.5��a=10 C��x=1.5��a=6 D��x=1.5��a=10��
���𰸡�
��1��CN��+H2O?HCN+OH��
��2��NaCN+H2O2+H2O�TNaHCO3+NH3��
��3��d��CN��+ClO���TCNO��+Cl����3S2O32��+4Cr2O72��+26H+�T6SO42��+8Cr3++13H2O��D
���������⣺��1���軯������ˮ������軯�⣬����ʽΪCN��+H2OHCN+OH�� �� ���Դ��ǣ�CN��+H2OHCN+OH������2���軯����˫��ˮ��Ӧ���ɰ�����̼�����ƣ�����ʽΪNaCN+H2O2+H2O�TNaHCO3+NH3�������Դ��ǣ�NaCN+H2O2+H2O�TNaHCO3+NH3������3�����̷�����CN����ˮ������ҺPH����NaClO��Һ������CN�����ӷ�Ӧ����CNO���ķ�ˮ����Cr2O72���ķ�ˮ������ҺPH����Na2S2O3����������ԭ��Ӧ�õ�����������ӵķ�ˮ���ͺ�CNO���ķ�ˮ���������õ�����ˮ����1�������̿���CN��ת��ΪCNO�� �� ���ϼ����߱�������������Cr2O72��ת��ΪCr3+���ϼ۽��ͣ��ʻ�ԭ����ԭ���ʲ��÷���Ϊ��������ԭ�������Դ��ǣ�d��2��������У�������ų���CN����ClO������ΪCNO�� �� ����Ϊ���ڼ��Ի����У���ClO��ֻ�ܱ���ԭΪCl�� �� ��ӦʽΪ��CN��+ClO���TCNO��+Cl����
���Դ��ǣ�CN��+ClO���TCNO��+Cl����3��ÿ0.4molCr2O72��ת��2.4mol�ĵ��ӣ��軹ԭ��CrԪ�صĻ��ϼ�Ϊx����0.4mol��2����6��x��=2.4mol�����x=+3�������ӷ�ӦΪ3S2O32��+4Cr2O72��+26H+�T6SO42��+8Cr3++13H2O��
���Դ��ǣ�3S2O32��+4Cr2O72��+26H+�T6SO42��+8Cr3++13H2O��4������1mol Cr2O72�� �� �����a mol FeSO47H2O�����ݸ�ԭ���غ�ã�1mol Cr2O72����ȫ��Ӧ������ ![]() molFe��[Fe��xCr��2��x]O4 �� ������ԭ���غ��amol=
molFe��[Fe��xCr��2��x]O4 �� ������ԭ���غ��amol= ![]() mol�٣��÷�Ӧ�е�ʧ��������ȣ�1mol��2��3=
mol�٣��÷�Ӧ�е�ʧ��������ȣ�1mol��2��3= ![]() mol����3��2����x�����x=1.5����x=1.5����ٵ�a=10��
mol����3��2����x�����x=1.5����x=1.5����ٵ�a=10��
���Դ��ǣ�D��

 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�����Ŀ����һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������ӦX��g��+Y��g��2Z��g������H��0��һ��ʱ���ﵽƽ�⣮��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
����˵����ȷ���ǣ� ��
A.0��2 min��ƽ������v��Z��=2.0��10��3 molL��1min��1
B.�����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ v��������v���棩
C.���¶��´˷�Ӧ��ƽ�ⳣ��K=144
D.�����������䣬�ٳ���0.2 mol Z��ƽ��ʱX�������������