题目内容
“绿色试剂”双氧水可作为矿业废液消毒剂,如要消除采矿业废液中的氰化物(如KCN),化学方程式为:KCN+H2O2+H2O=A+NH3↑
(1)生成物A的化学式为______.
(2)在标准状况下有0.448L氨气生成,则转移的电子为______mol.
(3)反应中被氧化的元素为______.
(4)H2O2被称为绿色氧化剂的理由是______.
解:(1)由质量守恒定律可知,反应前后的元素守恒、原子个数守恒,则A的化学式为KHCO3,故答案为:KHCO3;
(2)标准状况下有0.448L氨气生成,氨气的物质的量为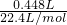 =0.02mol,C元素由+2升高为+4,则转移的电子数为0.02mol×(4-2)=0.04mol,故答案为:0.04;
=0.02mol,C元素由+2升高为+4,则转移的电子数为0.02mol×(4-2)=0.04mol,故答案为:0.04;
(3)元素的化合价升高时被氧化,该反应中只有C元素的化合价升高,故答案为:C(或碳);
(4)该氧化还原反应中还原产物为水,对环境无污染,则H2O2被称为绿色氧化剂,故答案为:还原产物为水,对环境无污染.
分析:(1)根据质量守恒定律来分析A的化学式;
(2)根据化合价的变化来计算转移的电子数;
(3)元素的化合价升高时被氧化;
(4)根据还原产物为水来分析.
点评:本题考查氧化还原反应,明确质量守恒定律及发生的化学反应、反应中元素的化合价变化是解答本题的关键,题目难度中等.
(2)标准状况下有0.448L氨气生成,氨气的物质的量为
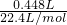 =0.02mol,C元素由+2升高为+4,则转移的电子数为0.02mol×(4-2)=0.04mol,故答案为:0.04;
=0.02mol,C元素由+2升高为+4,则转移的电子数为0.02mol×(4-2)=0.04mol,故答案为:0.04;(3)元素的化合价升高时被氧化,该反应中只有C元素的化合价升高,故答案为:C(或碳);
(4)该氧化还原反应中还原产物为水,对环境无污染,则H2O2被称为绿色氧化剂,故答案为:还原产物为水,对环境无污染.
分析:(1)根据质量守恒定律来分析A的化学式;
(2)根据化合价的变化来计算转移的电子数;
(3)元素的化合价升高时被氧化;
(4)根据还原产物为水来分析.
点评:本题考查氧化还原反应,明确质量守恒定律及发生的化学反应、反应中元素的化合价变化是解答本题的关键,题目难度中等.

练习册系列答案
相关题目

