题目内容
下列有关实验操作的叙述正确的是( )
| A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 |
| C.NaCl 溶液蒸发结晶时,蒸发皿中刚好有晶体析出时即停止加热 |
| D.向AlCl3溶液中滴加氨水,会产生白色沉淀,再加入NaHSO4溶液,沉淀不消失 |
B
解析试题分析:A乙醇与水互溶,不能作碘的萃取剂。错误。B.碱能使湿润的红色石蕊试纸变蓝。某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性。正确。C.NaCl溶液蒸发结晶时,蒸发皿有较多量晶体析出,剩余少许溶液时停止加热,利用余热将剩余溶液蒸干。错误。D.氢氧化铝是两性氢氧化物,既能与强酸反应,也能于强碱反应反应。向AlCl3溶液中滴加氨水,会产生氢氧化铝白色沉淀,再加入NaHSO4溶液时,NaHSO4电离产生的氢离子,起酸的作用。可以溶解氢氧化铝。所以沉淀消失。错误。
考点:考查萃取、蒸发等实验操作和气体的检验等知识。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案硫酸亚铁溶液含有杂质硫酸铜和硫酸铁,为除去杂质,提纯硫酸亚铁,应该加入下列哪种物质
| A.锌粉 | B.镁粉 | C.铁粉 | D.铝粉 |
下图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是( )
| A.NH4Al(SO4)2 | B.KAl(SO4)2 | C.Al2(SO4)3 | D.NaAlO2 |
在FeCl2和AlCl3的混合溶液中加入过量的氨水,直至溶液中沉淀的量不再改变为止。经过滤、洗涤、干燥、在空气中灼烧,最终剩余固体的成分是 ( )
| A.Fe2O3、Al2O3 | B.Fe2O3 |
| C.Fe (OH)2、Al(OH)3 | D.Fe(OH)3、Al(OH)3 |
将1 L 1.00 mol/L 的Na2CO3溶液逐滴加入到1 L 1.25 mol/L的盐酸中;再做相反操作:将1 L 1.25 mol/L的盐酸逐滴加入1 L 1.00 mol/L 的Na2CO3溶液中,两次操作产生的气体体积之比(同温同压下)是:( )
| A.1∶1 | B.2∶1 | C.5∶2 | D.2∶5 |
工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl=CuCl2+H2O
FeO+2HCl=FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是 ( )
| A.直接加碱,调整溶液pH≥9.6 |
| B.加纯铜粉,将Fe2+还原出来 |
| C.先将Fe2+氧化成Fe3+,再调整pH在3~4 |
| D.通入硫化氢,使Fe2+直接沉淀 |
将2.3 g金属钠放入100 g水中,完全反应后溶质的质量分数为( )
A.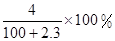 | B.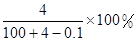 |
C.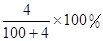 | D.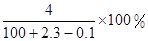 |
用一小粒钠投入水中,实验操作和过程中不可能感知或观察到的现象是
| A.钠的熔点低 | B.钠呈银白色、硬度小 |
| C.钠有延展性,导电性好 | D.钠具有强还原性 |
