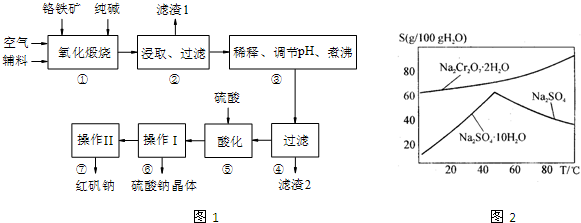
题目内容
重铬酸钠(Na2Cr2O7)广泛用作氧化剂、鞣革剂等。以铬矿石(主要成分为
03,还含有FeO、A1203、Si02等杂质)为原料制取重铬酸钠的流程如下:
请回答下列问题:
(1)Cr203在高温焙烧时反应的化学方程式为 。
(2)生产过程中,调节(含Na2Cr04、Na2Si03、NaAl02
的溶液)pH的目的是 。
(3)某化工厂采用石墨作电极电解Na2Cr04溶液,实现了
Na2Cr04转化为Na2Cr207的生产,其原理如下图所示。
①写出阳极的电极方程式: ;
②此生产方法和上述流程相比的优点主要有 。
(4)Na2Cr207可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被
氧化所需要的02的质量)。现有某水样100.00 mL,酸化后加入cl mol/L。的
Na2Cr207溶液 mL,使水中的还原性物质完全被氧化(还原产物为
mL,使水中的还原性物质完全被氧化(还原产物为 );再用
);再用
 的FeS04溶液滴定剩余的
的FeS04溶液滴定剩余的 ,结果消耗FeS04溶液
,结果消耗FeS04溶液 mL。则该水
mL。则该水
样的COD为  。
。
(1)2Cr2O3 + 4Na2CO3 + 3O2 4Na2CrO4 + 4CO2
(2)使SiO32—、AlO2—生成H2SiO3和Al(OH)3沉淀
(3)①4OH― ― 4e-= O2↑+ 2H2O
② 不引入其他离子(或物质),同时副产氢气和NaOH等
(4)480c1V1 — 80 c2V2
解析

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
工业上以铬铁矿(主要成分为FeO.Cr2O3)碳酸钠、氧气和硫酸为原料生产重铬酸钠Na2Cr2O7?2H20),其主要反应为:
①4Fe?Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
①4Fe?Cr2O3+8Na2CO3+7O2
| ||
②2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
| A、反应①和②均为氧化还原反应 |
| B、反应①的氧化剂是O2,还原剂是FeO?Cr2O3 |
| C、高温下,O2的氧化性大于Fe3O3小于NaCrO4. |
| D、生成1mol的Na2Cr2O7时整个反应过程共转移6mol电子 |

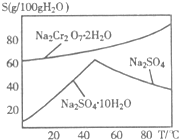 重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下:
重铬酸钠(Na2Cr2O7)主要用于印染、制革、医药、电镀等.工业上以铬铁矿(主要成分FeO?Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7?2H2O)的主要反应如下: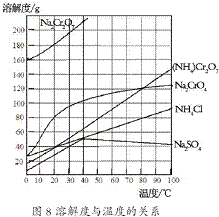 (2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:
(2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下: