题目内容
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。

(1)物质A的化学式为___,F化学式为___;
(2)B和R在溶液中反应生成F的离子方程式为___;
(3)H在潮湿空气中变成M的实验现象是___,化学方程式为___。
(4)A和水反应生成B和C的离子方程式为___,由此反应可知A有作为___的用途。
(5)M投入盐酸中的离子方程式___。
【答案】Na2O2 H2 2Al+2OH-+2H2O=2AlO2-+3H2↑ 白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Na2O2+2H2O=4Na++4OH-+O2↑ 供氧剂 Fe(OH)3+3H+=Fe3++3H2O
【解析】
A为淡黄色固体,其能与水反应,则其为Na2O2;R是地壳中含量最多的金属元素的单质,则其为Al;T为生活中使用最广泛的金属单质,则其为Fe;D是具有磁性的黑色晶体,则其为Fe3O4;Na2O2与水反应生成NaOH和O2,所以C为O2;Al与NaOH溶液反应,生成偏铝酸钠和氢气,所以F为H2,B为NaOH;Fe3O4与盐酸反应,生成FeCl3、FeCl2和水,FeCl3再与Fe反应,又生成FeCl2,所以E为FeCl2;它与NaOH溶液反应,生成白色沉淀Fe(OH)2,它是H;Fe(OH)2在空气中被氧化为Fe(OH)3,它与盐酸反应生成FeCl3,它为W。
(1)物质A的化学式为Na2O2。答案为:Na2O2
F化学式为H2。答案为:H2
(2)NaOH和Al在溶液中反应生成H2的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)Fe(OH)2在潮湿空气中变成Fe(OH)3的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色。答案为:白色沉淀迅速变成灰绿色,最终变成红褐色
化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(4)Na2O2和水反应生成NaOH和O2的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
答案为:2Na2O2+2H2O=4Na++4OH-+O2↑
由此反应可知A有作为供氧剂的用途。答案为:供氧剂
(5)Fe(OH)3投入盐酸中的离子方程式Fe(OH)3+3H+=Fe3++3H2O。
答案为:Fe(OH)3+3H+=Fe3++3H2O

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】下列实验方案不能达到相应目的的是
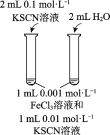
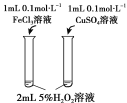
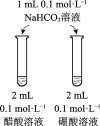
A | B | C | D | |
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D