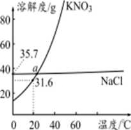
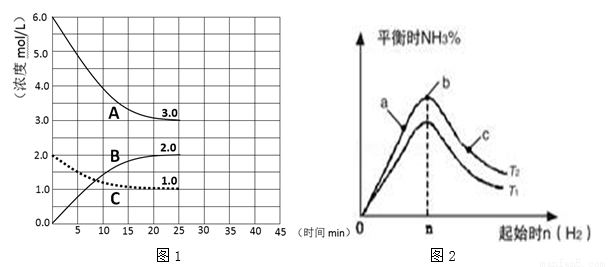
题目内容
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L的CH3Cl中所含质子数为26NA
B.将100mL0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒的数目为0.01NA
C.常温下,1L0.1mol/L醋酸中含有的离子总数为0.2NA
D.0.1molC2H2气体中,原子间含有的共用电子对数目为0.3NA
 阅读快车系列答案
阅读快车系列答案【化学——选修3:物质结构与性质】原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为__________________。
(4)Z与R能形成化合物甲,1 mol甲中含________ mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为_________________________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为___________________。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1 539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应过程中的离子方程式
为________________________;________________________。
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子;
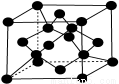
若X晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则该晶胞的体积为________ cm3 (用代数式表示)。
某学校实验室从化学试剂商店买回18.4 mol·L-1的硫酸。现用该浓硫酸配制100 mL 1 mol·L-1的稀硫酸。可供选用的仪器有:①胶头滴管; ②烧瓶; ③烧杯; ④药匙; ⑤量筒; ⑥托盘天平。请回答下列问题:
(1)配制稀硫酸,上述仪器中不需要的有 (选填序号),还缺少的仪器有 (写仪器名称)。
(2)配制100mL 1mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数)。量取浓硫酸时应选用 (选填①10 mL、②50 mL、③100 mL)规格的量筒。
(3)实验中造成所配溶液浓度偏高的原因可能是 。
A.容量瓶中原来含有少量蒸馏水 |
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容 |
C.烧杯没有洗涤 |
D.向容量瓶中加水定容时眼睛一直仰视刻度线 |


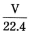
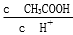 比值不变
比值不变