题目内容
14.常温常压下,将1体积某烯烃和4体积某烷烃混合,所得混合气体的体积是相同条件下等质量氢气体积的$\frac{1}{12}$,则这两种烃是( )| A. | CH4和C4H8 | B. | CH4和C3H6 | C. | C2H6 和C3H6 | D. | C2H6 和C4H8 |
分析 混合气体的体积是相同条件下等质量氢气体积的$\frac{1}{12}$,混合气体的平均相对分子质量为12×2=24,由于烯烃中乙烯的相对分子质量最小为28,故含有的烷烃为甲烷,结合体积比计算烯烃的相对分子质量,进而确定烯烃的分子式.
解答 解:混合气体的体积是相同条件下等质量氢气体积的$\frac{1}{12}$,混合气体的平均相对分子质量为12×2=24,由于烯烃中乙烯的相对分子质量最小为28,故含有的烷烃为甲烷,
假设烯烃相对分子质量为a,则$\frac{a+16×4}{1+4}$=24,解得a=56,
令烯烃组成为CnH2n,则14n=56,故n=4,则相同分子式为C4H8,
故选A.
点评 本题考查有机物推断,难度不大,关键是利用平均相对分子质量确定含有甲烷,侧重考查学生分析计算能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
4.下列关于海水综合利用的叙述不正确的是( )
| A. | 利用空气吹出SO2吸收法从海水中提溴时,直接将海水氯化,然后再进行吹出、吸收可得到溴产品 | |
| B. | 从海水中提取的重水可作原子能反应堆的中子减速剂和传热介质 | |
| C. | 盐田法制盐时,所用的盐田一般分成贮水池、蒸发池、结晶池三部分 | |
| D. | 利用电渗析法,冷冻法制盐,同时也可以得到淡水 |
5.已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.
请根据信息回答有关问题:
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C.
(3)X、Z元素均表现最低化合价时的氢化物中,沸点由高到低的排列次序为(写化学式)H2O>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3)xQ2]+,该配合物离子为(写化学式)[Co (NH3)4Cl2]+.
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2=N2+6H2O.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C.
(3)X、Z元素均表现最低化合价时的氢化物中,沸点由高到低的排列次序为(写化学式)H2O>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E (YH3)xQ2]+,该配合物离子为(写化学式)[Co (NH3)4Cl2]+.
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2=N2+6H2O.
2.下列关于物质结构的说法中正确的是( )
| A. | BF3、HClO分子中所有原子都满足最外层8电子结构 | |
| B. | 某元素原子最外层电子数是次外层电子数的a(a为整数)倍,则该原子核内质子数为2a+2 | |
| C. | D2O分子与H2O分子是所含电子总数不相等的分子 | |
| D. | 在任何物质分子中都含有化学键 |
19.通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下列是一些化学键的键能
根据键能数据估算下列反应的反应热△H为:CH4 (g)+4F2 (g)═CF4(g)+4HF(g)( )
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | -1940 kJ•mol-1 | B. | 1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | 485 kJ•mol-1 |
6.下列化学用语或模型正确的是( )
| A. | 氯化氢的电子式: | B. | 硫离子结构示意图: | ||
| C. | 8个中子的碳原子:12C | D. | CH4分子的比例模型: |
3.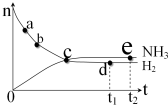 对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是( )
对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是( )
 对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是( )
对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是( )| A. | 点c处于正反应速率和逆反应速率相等 | |
| B. | 点a的正反应速率比点b的大 | |
| C. | 点d (t1时刻) 和点 e (t2时刻) 处n(N2)不同 | |
| D. | 在t2时刻,正反应速率大于逆反应速率 |
4.Ⅰ.在发射“神舟”七号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热.
已知:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641kJ•mol-1
H2O(l)═H2O(g)△H=+44 kJ•mol-1
(1)若用3.2g液态肼与足量过氧化氢反应生成氮气和液态水,则整个过程中转移的电子的物质的量为0.4mol,该反应的热化学方程式为N2H4(l)+2H2O2(l)=N2 (g)+4H2O (l)△H=-817.6 kJ/mol.
(2)肼(N2H4)中N元素的杂化方式是sp3杂化,过氧化氢的电子式为
Ⅱ.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5,因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(3)将PM2.5样本用蒸馏水处理制成室温待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5待测试样的pH=4.
(4)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料水煤气.
写出焦炭与水蒸气反应的化学方程式(注明反应条件):C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2.
水煤气除可用作燃料气外,请列举一种水煤气的其他用途做还原剂冶炼金属
②洗涤含SO2的烟气.以下物质可作洗涤剂的是bd.
a. Na2SO4 b.Na2CO3 c.CaCl2 d.NaHS.
已知:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641kJ•mol-1
H2O(l)═H2O(g)△H=+44 kJ•mol-1
(1)若用3.2g液态肼与足量过氧化氢反应生成氮气和液态水,则整个过程中转移的电子的物质的量为0.4mol,该反应的热化学方程式为N2H4(l)+2H2O2(l)=N2 (g)+4H2O (l)△H=-817.6 kJ/mol.
(2)肼(N2H4)中N元素的杂化方式是sp3杂化,过氧化氢的电子式为

Ⅱ.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5,因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(3)将PM2.5样本用蒸馏水处理制成室温待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(4)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料水煤气.
写出焦炭与水蒸气反应的化学方程式(注明反应条件):C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2.
水煤气除可用作燃料气外,请列举一种水煤气的其他用途做还原剂冶炼金属
②洗涤含SO2的烟气.以下物质可作洗涤剂的是bd.
a. Na2SO4 b.Na2CO3 c.CaCl2 d.NaHS.