题目内容
【题目】某研究小组利用BaS的还原性提纯HBr溶液,并制取溴化镁的方案如下:
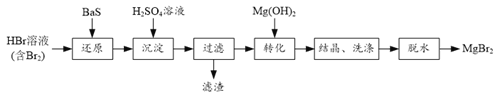
(1) “还原”步骤中BaS不宜过量太多的原因是______。
(2)滤渣的成分是______。
(3)结晶获得的MgBr2·6H2O用乙醇洗涤,从洗涤液中回收乙醇的实验方法是______。
(4)利用如图装置将MgBr2·6H2O脱水得到MgBr2。
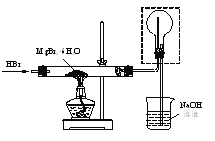
①通入HBr的目的是______。
②图中框内装置的作用是______。
(5)已知:BaS+H2O2=Ba(OH)2+S↓。请补充完整实验室由BaS制取高纯BaSO3的实验方案:取BaS加水浸出,边搅拌边在浸出液中加入过量H2O2,过滤,______,(实验中须使用的试剂有:SO2气体,溶有SO2的水,除常用仪器外须使用的仪器有:真空干燥箱、pH计)。
【答案】 后续反应会使用更多的H2SO4、实验过程中会产生有毒的H2S气体 S、BaSO4 蒸馏 带走水蒸气,抑制MgBr2的水解 防止倒吸 将滤液加热煮沸,向冷却后的溶液中缓慢通入SO2气体至反应液的pH约为7(用pH计测得),过滤,用溶有SO2的水洗涤滤渣,在真空干燥箱中干燥
【解析】(1) “还原”步骤中BaS与溴反应生成硫酸钡沉淀或硫沉淀,过量的BaS会与氢溴酸和硫酸反应放出硫化氢气体,因此BaS不宜过量太多,故答案为:后续反应会使用更多的H2SO4、实验过程中会产生有毒的H2S气体;
(2)根据(1)的分析,沉淀中含有硫酸钡沉淀或硫沉淀和过量的BaS,加入硫酸,将沉淀中的BaS溶解,得到的滤渣中主要含有S、BaSO4,故答案为:S、BaSO4;
(3)结晶获得的MgBr2·6H2O用乙醇洗涤,乙醇的沸点降低,可以通过蒸馏的方法从洗涤液中回收乙醇,故答案为:蒸馏;
(4)①MgBr2水解会放出溴化氢气体,通入HBr,可以带走水蒸气,抑制MgBr2的水解,故答案为:带走水蒸气,抑制MgBr2的水解;
②图中框内装置是安全瓶,可以防止倒吸,故答案为:防止倒吸;
(5)由BaS制取高纯BaSO3。取BaS加水浸出,边搅拌边在浸出液中加入过量H2O2,BaS+H2O2=Ba(OH)2+S↓,过滤除去硫,得到氢氧化钡溶液,其中含有少量过量的过氧化氢溶液,加热,使过氧化氢分解,然后在氢氧化钡溶液中通入二氧化硫气体,恰好完全反应后溶液中含有水,pH=7,过滤出BaSO3沉淀,用溶有SO2的水洗涤,在隔绝空气的环境中干燥即可,故答案为:将滤液加热煮沸,向冷却后的溶液中缓慢通入SO2气体至反应液的pH约为7(用pH计测得),过滤,用溶有SO2的水洗涤滤渣,在真空干燥箱中干燥。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)某小组拟用酸性KMnO4溶液与H2C2O4溶液的反应(此反应为放热反应)来探究“条件对化学反应速率的影响,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。
限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010 mol/L KMnO4溶液(酸性)、MnSO4、蒸馏水、试管、量筒、秒表、恒温水浴槽。
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010 mol/L酸性KMnO4溶液)/mL | m(MnSO4)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.5 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题:
①写出上述反应的离子方程式:________________________。
②上述实验①②是探究____________对化学反应速率的影响;上述实验②④是探究____________对化学反应速率
影响。若上述实验②③是探究浓度对化学反应速率的影响,则a为______________;表格中的“乙”填写t/s,其测量的是______________________。
③实验①中对“乙”重复测量三次,所得数值分别13.6,13.5,13.4。忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=___________ 。
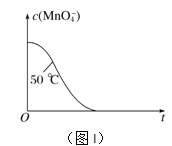
④已知实验①50℃时c(MnO![]() )~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO
)~反应时间t的变化曲线如图I。若保持其他条件不变,请在坐标图中,画出实验②25℃时c(MnO![]() )~t的变化曲线示意图。______________
)~t的变化曲线示意图。______________
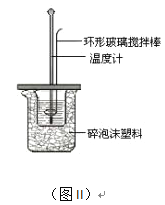
(2)测定中和热的实验装置如图II所示。
①写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式_______________________(中和热数值为57.3 kJ/mol):
②取60mL0.50mol/L NaOH溶液和50mL0.50mol/L硫酸溶液进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.9 | |
2 | 26.2 | 26.4 | 26.3 | 30.6 | |
3 | 25.9 | 25.9 | 25.9 | 29.5 | |
4 | 26.4 | 26.2 | 26.3 | 30.0 | |
近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=________________________kJ/mol(列出计算式)。
③能引起中和热偏高的原因是(填字母)__________。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.用50mL0.50mol/L醋酸代替了硫酸进行反应,
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
E. 量取硫酸溶液的体积时仰视读数