题目内容
 A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大.A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大.A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:(1)A、B、C的第一电离能由小到大的顺序为
(2)D与E的原子化热分别为340kJ?mol-1和400kJ?mol-1,则它们的熔点:D
(3)分子A2B2中键与键之间的夹角为180°,并有对称性,为非极性分子,每个原子最外层电子数均满足八电子,其结构式为
(4)基态E原子的外围电子排布式为
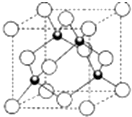
(5)D的氢化物的晶体结构如图所示,其化学式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大,B原子的最外层p轨道的电子为半满结构,最外层电子排布为2s22p3,故B为N元素,第2周期元素A原子的核外成对电子数是未成对电子数的2倍,故原子核外电子排布为1s22s1或1s22s22p2,A的原子序数小于氮,故A为C元素,C是地壳中含量最高的元素,所以C是O元素,D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,是29号Cu元素,E原子核外未成对电子数在同周期中最多,则E为Cr元素,据此解答.
解答:
解:A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大,B原子的最外层p轨道的电子为半满结构,最外层电子排布为2s22p3,故B为N元素,第2周期元素A原子的核外成对电子数是未成对电子数的2倍,故原子核外电子排布为1s22s1或1s22s22p2,A的原子序数小于氮,故A为C元素,C是地壳中含量最高的元素,所以C是O元素,D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,是29号Cu元素,E原子核外未成对电子数在同周期中最多,则E为Cr元素,
(1)C、N、S元素是同一周期元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,由于水分子之间有氢键存在,且H2O为极性分子,所以水的沸点要比甲烷高,
故答案为:C<O<N;H2O>CH4; H2O分子间存在分子间氢键,且H2O为极性分子;
(2)由于铜的原子化热比铬的低,所以铜的金属键的键能小于铬,所以铜的熔点小一铬,
故答案为:<;
(3)分子C2N2中键与键之间的夹角为180°,并有对称性,为非极性分子,每个原子最外层电子数均满足八电子,所以其结构式为N≡C-C≡N,1mol该分子中含有π键的数目为4NA,
故答案为:N≡C-C≡N;4NA;
(4)E为铬元素,原子的外围电子排布式为3d54s1,CrO2Cl2的熔点、沸点都较低,所以它是属于分子晶体,
故答案为:3d54s1;分子;
(5)利用均摊法,根据铜的氢化物的晶体结构可知,每个晶胞中含有铜原子数为8×
+6×
=4,含有氢原子数为4,所以该化合物的化学式为CuH,
故答案为:CuH.
(1)C、N、S元素是同一周期元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,由于水分子之间有氢键存在,且H2O为极性分子,所以水的沸点要比甲烷高,
故答案为:C<O<N;H2O>CH4; H2O分子间存在分子间氢键,且H2O为极性分子;
(2)由于铜的原子化热比铬的低,所以铜的金属键的键能小于铬,所以铜的熔点小一铬,
故答案为:<;
(3)分子C2N2中键与键之间的夹角为180°,并有对称性,为非极性分子,每个原子最外层电子数均满足八电子,所以其结构式为N≡C-C≡N,1mol该分子中含有π键的数目为4NA,
故答案为:N≡C-C≡N;4NA;
(4)E为铬元素,原子的外围电子排布式为3d54s1,CrO2Cl2的熔点、沸点都较低,所以它是属于分子晶体,
故答案为:3d54s1;分子;
(5)利用均摊法,根据铜的氢化物的晶体结构可知,每个晶胞中含有铜原子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:CuH.
点评:本题主要考查了元素周期律、分子的极性、氢键、结构式、晶体的性质、晶胞的结构等知识,中等难度,解题的关键在于元素的推断.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
要鉴别己烯中是否混有少量甲苯,正确的实验方法是( )
| A、点燃这种液体,然后观察火焰的颜色 |
| B、先加足量酸性高锰酸钾溶液,然后再加入溴水 |
| C、加入浓硫酸与浓硝酸后加热 |
| D、先加足量溴水,然后再加入酸性高锰酸钾溶液 |
难挥发性二硫化钽(TaS2)可采用如图装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后加入适量碘并封管,置于加热炉中,发生反应:TaS2(s)+2I2(g)
TaI4(g)+S2(g).下列说法正确的是( )
| 1123K |
| 1023K |

| A、在不同温度区域,TaI4的量保持不变 |
| B、在提纯过程中,I2的量不断减少 |
| C、该反应的平衡常数与TaI4和S2的浓度乘积成反比 |
| D、在提纯过程中,I2的作用是将TaS2从高温区转移到低温区 |
设C+CO2?2CO△H>0(吸热反应)反应速率为 v1,N2+3H2?2NH3△H<0 (放热反应)反应速率为 v2,对于上述反应,当温度升高时,v1和v2的变化情况为( )
| A、都增大 |
| B、都减小 |
| C、?v1增大,?v2减小 |
| D、?v1减小,?v2增大 |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3=bO2↑+c Cl2↑+d HClO4+e H2O.下列有关说法不正确的是( )
| A、由反应可确定:氧化性HClO3>O2 |
| B、若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为:3HClO3=2O2↑+C12↑+HClO4+H2O |
| C、由非金属性Cl>S,可推知酸性HClO3>H2SO4 |
| D、若化学计量数a=8,b=3,则该反应转移电子数为20 |
如果Mg2-、NO3-、Na-和M四种离子以物质的量之比为1:2:4:2共同存在同一种溶液中,那么M可能是( )
| A、K+ |
| B、Cl- |
| C、CO32- |
| D、SO42- |
下列关于氯气的叙述正确的是( )
| A、氢气在氯气中燃烧产生苍白色火焰 |
| B、氯气的水溶液用于漂白,是利用氯气的强氧化性 |
| C、铁丝在氯气中燃烧生成FeCl2 |
| D、当有大量氯气逸到空气中时,可用浸有NaOH溶液的毛巾捂住鼻子 |