题目内容
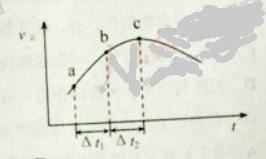
【题目】已知A、B、C、D、X、Y六种物质均由短周期元素组成,其中X为常见离子化合物,它们之间的转换关系如下图所示

(1)已知条件I和条件II相同,则该反应条件为____________________ 。
(2)物质X的电子式为_____________________ 。
(3)写出B与Ca(OH)2反应的化学方程式______________________________ 。
(4)写出X在条件II下反应生成B、C、D的离子方程式_____________________________________________ 。
(5)写出实验室制B的化学方程式,并标出电子转移方向、数目____________________________________________ 。
(6)请简述鉴定物质X的实验方法____________________________________。
【答案】通电 ![]() 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2Cl-+2H2O
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ 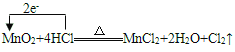 (用双线桥表示也可) 用焰色反应检验Na+,用硝酸银和稀硝酸检验Cl-
(用双线桥表示也可) 用焰色反应检验Na+,用硝酸银和稀硝酸检验Cl-
【解析】
X为离子化合物,左边为熔融液,右边为水溶液,说明X易溶于水,则只可能为NaCl、MgCl2。若X为MgCl2,电解其水溶液,生成Mg(OH)2、H2、Cl2,电解其熔融液时,生成Mg、H2。则B为Cl2,A为Mg,但Mg生成Mg(OH)2时,需要与水反应,而Mg与H2O不反应,所以X只能为NaCl。从而得出A为Na,B为Cl2,C、D为NaOH、H2中的一种,Y为H2O。
(1)已知条件I和条件II相同,则该反应条件为通电。
(2)物质X为NaCl,由此可写出其电子式。
(3)Cl2与Ca(OH)2反应,用于生产漂白粉。
(4)X为NaCl,在条件II下,电解氯化钠的水溶液,反应生成NaOH、Cl2、 H2。
(5)实验室制Cl2是利用MnO2与浓盐酸在加热条件下制得。
(6)鉴定物质NaCl时,既要鉴定Na+,又要鉴定Cl-。
(1)已知条件I和条件II相同,则该反应条件为通电。答案为:通电;
(2)物质X为NaCl,其电子式为![]() 。答案为:
。答案为:![]() ;
;
(3)Cl2与Ca(OH)2反应,化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)X为NaCl,在条件II下,电解氯化钠的水溶液,反应的离子方程式为2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑。答案为:2Cl-+2H2O
2OH-+Cl2↑+H2↑。答案为:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑;
2OH-+Cl2↑+H2↑;
(5)实验室制Cl2是利用MnO2与浓盐酸在加热条件下制得,表示电子转移方向和数目的方程式为 。答案为:
。答案为: (用双线桥表示也可);
(用双线桥表示也可);
(6)鉴定物质NaCl时,既要鉴定Na+,又要鉴定Cl-,鉴定Na+用焰色反应,鉴定Cl-用硝酸银和稀硝酸。答案为:用焰色反应检验Na+,用硝酸银和稀硝酸检验Cl-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】高炉炼铁过程中发生反应:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
温度 | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
A.ΔH>0
B.1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO、CO2的物质的量分别为0.5 mol、1.8 mol,此时反应向正反应方向进行
C.其他条件不变,向平衡体系充入CO2气体,K值减小
D.其他条件不变,升高温度,可以提高CO的平衡转化率