题目内容
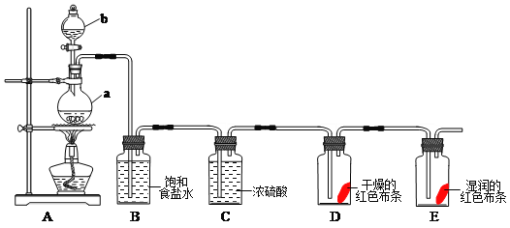
【题目】海水晒盐的卤水中还有氧化镁,以卤水为原料生产镁的一种工艺流程如下图所示。

回答下列问题:
(1)脱硫槽、搅拌槽均用于脱除卤水中的________(填离子符号),M的主要成分是________(填化学式)。
(2)除溴塔中主要的离子方程式为___________________________________________。
(3)沸腾炉①和②的主要作用是________。沸腾炉③通入热氯化氢的主要目的是______________________________________。
(4)电解槽中阴极的电极反应方程式为______________________________________。
(5)电解槽中阳极产物为________,该产物可直接用于本工艺流程中的____________________。
【答案】SO42- BaSO4 Cl2+2Br-=2Cl-+Br2 脱除氯化镁晶体的部分水 防止氯化镁晶体进一步脱水过程中发生水解 Mg2++2e-=Mg 氧气 除溴塔(除溴阶段)
【解析】
卤水中含有Mg2+、Na+、Cl-、SO42-、Br-等离子,卤水中加入CaO在脱硫槽除去SO42-,生成CaSO4,经过滤机①得到X为CaSO4,经除溴塔,通入氯气,可除去Br-,生成Z为Br2,在搅拌槽中加入BaO,进一步除去SO42-,M的主要成分是BaSO4,经蒸发器、造粒塔,得到氯化镁晶体,再经沸腾炉①和②脱除氯化镁晶体中的部分水,沸腾炉③通入热的HCl气体,可防止发生水解,在电解槽中电解熔融的氯化镁,可得到镁锭。
(1)由以上分析可知脱硫槽、搅拌槽均用于脱除卤水中的 SO42-,M的主要成分是BaSO4,故答案为:SO42-;BaSO4;
(2)除溴塔中通入氯气,以除去Br-,反应的离子方程式为Cl2+2Br-=2Cl-+Br2,故答案为:Cl2+2Br-=2Cl-+Br2;
(3)经沸腾炉①和②脱除氯化镁晶体中的部分水,因氯化镁易水解生成氢氧化镁,则沸腾炉③通入热的HCl气体,可防止发生水解,
故答案为:脱除氯化镁晶体中的部分水;防止氯化镁晶体进一步脱水过程中发生水解;
(4)电解氯化镁生成镁和氯气,阴极发生还原反应,电极方程式为Mg2++2e-=Mg,故答案为:Mg2++2e-=Mg;
(5)阳极生成氯气,可用于除溴塔,除去溴,故答案为:氯气;除溴塔(除溴工段)。

【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D
【题目】在恒容条件下,反应:2SO2 (g) + O2 (g) ![]() 2SO3(g) ΔH =-QkJ·mol-1。在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
2SO3(g) ΔH =-QkJ·mol-1。在上述条件下分别充入的气体和反应放出的热量 ( Q>0 )如下表所列:
容器 | SO2 (mol) | O2(mol) | N2(mol) | Q(kJ·mol-1) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A. 在上述条件下反应生成lmol SO3固体放热Q/2 kJ B. 2Q3 <2Q2=Q1<Q
C. Ql =2Q2= 2Q3 = Q D. 2Q2 = 2Q3 < Q1 < Q