��Ŀ����
����Ŀ��ij�о���ѧϰС������������о�����ˮ��Ӧ���ù������ʵijɷ֡����ʼ���������ʵ��̽��������ͬ����������⣺
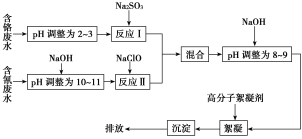
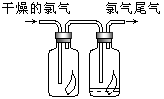
̽��һ �����ͼ��ʾװ�ý���������ˮ��Ӧ����ʵ��(�г�������)��

(1)Ӳ�ʲ�����B�з�����Ӧ�Ļ�ѧ����ʽΪ__________________________��
(2)��ӦǰA��Ͷ�����Ƭ��Ŀ����____________________��
(3)װ��E�е�������________________________________��
̽���� �������ʵ�鷽��ȷ����Ӧ��Ӳ�ʲ�����B�к�ɫ����ijɷ֡�
(4)��Ӳ�ʲ�����B��ȴ��ȡ�������еĹ�����������ϡ�����������Һ�ֳ����ݡ�
��һ�ݵμӼ���KSCN��Һ������Һ��Ѫ��ɫ���ƶ�Ӳ�ʲ�����B�й������ʵijɷ�Ϊ________(ѡ����ţ���ͬ)������Һδ��Ѫ��ɫ���ƶ�Ӳ�ʲ�����B�й������ʵijɷ�Ϊ________��
A��һ����Fe3O4 B��һ����Fe C��ֻ��Fe3O4 D��ֻ��Fe
�� ��һ���ý�ͷ�ιܵμ�����KMnO4��Һ������Һ��ɫ������֤����Һ�д��� (�����ӷ���)��
�� �����Լ��У�����ʹFe3��ת��ΪFe2������
A������
B��Fe
C��H2O2
D��ϡ����
E��Cu
���𰸡�(1)3Fe��4H2O(g)![]() Fe3O4��4H2 (2)(1��)��ֹ����
Fe3O4��4H2 (2)(1��)��ֹ����
(3)(1��)��ɫ�����죬�Ҷ˹ܱ���ˮ��
(4)��A �� B �� Fe2+ �� A C D(ȫ��2�֣�©ѡ1�֣���ѡ0��)
��������
�����������̽��һ��(1)Ӳ�ʹ�������ˮ�����ڸ����·�Ӧ������������������������Ӧ�Ļ�ѧ����ʽΪ��3Fe+4H2O(g)![]() Fe3O4+4H2��
Fe3O4+4H2��
(2)Һ�����ʱ�������������������Ƭ�������Ƿ�ֹ���У�
(3)װ��E�з�����ӦΪ��H2+CuO![]() Cu+H2O����Ӧ�����ǣ���ɫ�����죬�Ҷ˹ܱ���ˮ�飻
Cu+H2O����Ӧ�����ǣ���ɫ�����죬�Ҷ˹ܱ���ˮ�飻
��̽������(4)����֤��Ӧ���ɫ����ijɷ�ʱ������Fe3+������Լ�ΪKSCN��Һ����ȷ������Fe3+ʱ������Fe2+����������KMnO4��Һ����������KMnO4��Һ�����ᷢ����Ӧ���������ܽⷴӦ��ĺ�ɫ����ʱ�����������ᣬҲ����������(��ΪHNO3������Fe2+)������ϡ���
��һ�ݵμӼ���KSCN��Һ������Һ��Ѫ��ɫ��˵����Һ�к��������ӣ�����ƶ�Ӳ�ʲ�����B�й������ʵijɷ�Ϊ��A��һ����Fe3O4������Һδ��Ѫ��ɫ������Һ�в����������ӣ����ƶ�Ӳ�ʲ�����B�й���������һ������Fe����B��ȷ���ʴ�ΪAB��
���ý�ͷ�ιܼ������Ը��������Һ�������Ը��������Һ��ɫ����֤����Һ�к����������ӣ�
��Fe3��ת��ΪFe2���Ĺ����ǻ�ԭ���̣���Ҫ���ӻ�ԭ������������H2O2��ϡ���������ǿ�����ԣ�ֻ�ܽ�Fe2������ΪFe3�����ʴ�ΪACD��