题目内容
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该盐酸中HCl的物质的量浓度为
11.9
11.9
mol?L-1(2)某同学用上述浓盐酸和蒸馏水配制浓度为0.4mol?L-1体积为425mL的稀盐酸.
①该学生需要取
16.8
16.8
mL上述浓盐酸进行配制.②配制过程中,所用到的仪器除烧杯、玻璃棒、量筒外还需
胶头滴管
胶头滴管
、500mL容量瓶
500mL容量瓶
.③上述实验中,需要用到玻璃棒,其作用是
搅拌溶解
搅拌溶解
、引流
引流
.④在配制过程中,下列操作对配制的稀盐酸的物质的量浓度有何影响(填“偏 大”、“偏小”或“无影响”)
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面
偏小
偏小
Ⅱ.定容时仰视刻度线
偏小
偏小
.分析:(1)根据浓盐酸试剂瓶标签数据计算出物质的量浓度;
(2)①根据配制的溶液需要氯化氢的物质的量计算出需要浓盐酸的体积;
②根据配制有的物质的量浓度的溶液的步骤选择使用的仪器;
③根据玻璃棒在配制过程中的作用完成;
④根据实验操作对物质的量浓度c=
产生的影响进行判断.
(2)①根据配制的溶液需要氯化氢的物质的量计算出需要浓盐酸的体积;
②根据配制有的物质的量浓度的溶液的步骤选择使用的仪器;
③根据玻璃棒在配制过程中的作用完成;
④根据实验操作对物质的量浓度c=
| n |
| V |
解答:解:(1)1L该浓盐酸中含有的氯化氢的质量为:
mol=11.9mol,该盐酸的物质的量浓度为:11.9mol/L,
故答案为:11.9;
(2)①配制浓度为0.4mol?L-1体积为425mL的稀盐酸,实验室没有425mL容量瓶,所以选用500mL容量瓶,需要配制500mL溶液;需要氯化氢的物质的量为:0.4mol/L×0.5L=0.2mol,需要浓盐酸的体积为:
≈16.8mL,
故答案为:16.8;
②配制500mL浓度为0.4mol?L-1的稀盐酸的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还需要胶头滴管和500mL容量瓶,
故答案为:胶头滴管;500mL容量瓶;
③在稀释浓盐酸用到玻璃棒进行搅拌溶解;转移溶液时用到玻璃棒引流,
故答案为:搅拌溶解;引流;
④Ⅰ.用量筒量取浓盐酸时俯视观察凹液面,导致量取的浓盐酸体积偏小,配制的溶液中溶质物质的量偏小,溶液浓度偏小,
故答案为:偏小;
Ⅱ.定容时仰视刻度线,导致加入的蒸馏水体积偏大,配制的溶液的浓度偏小,
故答案为:偏小.
| 1.19×1000×36.5% |
| 36.5 |
故答案为:11.9;
(2)①配制浓度为0.4mol?L-1体积为425mL的稀盐酸,实验室没有425mL容量瓶,所以选用500mL容量瓶,需要配制500mL溶液;需要氯化氢的物质的量为:0.4mol/L×0.5L=0.2mol,需要浓盐酸的体积为:
| 0.2mol |
| 11.9mol/L |
故答案为:16.8;
②配制500mL浓度为0.4mol?L-1的稀盐酸的步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还需要胶头滴管和500mL容量瓶,
故答案为:胶头滴管;500mL容量瓶;
③在稀释浓盐酸用到玻璃棒进行搅拌溶解;转移溶液时用到玻璃棒引流,
故答案为:搅拌溶解;引流;
④Ⅰ.用量筒量取浓盐酸时俯视观察凹液面,导致量取的浓盐酸体积偏小,配制的溶液中溶质物质的量偏小,溶液浓度偏小,
故答案为:偏小;
Ⅱ.定容时仰视刻度线,导致加入的蒸馏水体积偏大,配制的溶液的浓度偏小,
故答案为:偏小.
点评:本题考查了配制有的物质的量浓度的溶液的方法及误差分析,题目难度不大,要求学生掌握配制一定物质的量浓度的溶液的步骤及误差分析的方法与技巧.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: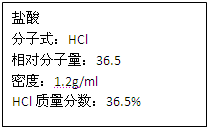 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题: