题目内容
 实验室在没有浓盐酸的情况下,常用浓硫酸、食盐和二氧化锰在加热条件下制取氯气,发生反应的化学方程式为2NaCl+3H2SO4(浓)+MnO2
实验室在没有浓盐酸的情况下,常用浓硫酸、食盐和二氧化锰在加热条件下制取氯气,发生反应的化学方程式为2NaCl+3H2SO4(浓)+MnO2
|
(1)制氯气时,先在烧瓶里加入一定量的二氧化锰和氯化钠,通过分液漏斗向烧瓶中加入一定量的浓硫酸,烧瓶里产生氧气的化学反应方程式为
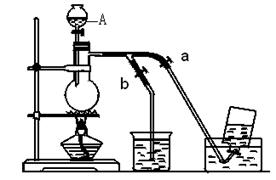
(2)请从图中选用所需的仪器(可重复使用)组成一套制取氯气的装置,既要完成“观察氯气使紫色石蕊试液变色实验”、“做氯气是否具有漂白性实验”、“验证氯气的氧化性比碘单质的氧化性强的实验”,又要探究“有氧气产生的实验”.现提供二氧化锰、浓硫酸、食盐粉末、紫色石蕊试液、碱石灰、淀粉-KI溶液,其他试剂自选.将所用的仪器按连接顺序由上至下依次填入表中(其中C装置只起收集氯气的作用),并写出对应仪器中应加试剂的名称.
| 选用的仪器 | 加入试剂 |
| A | 食盐粉末、二氧化锰、浓硫酸 |
| B | 紫色石蕊试液 |
| 淀粉-KI溶液 | |
(3)实验中观察装有紫色石蕊试液的洗气瓶中的颜色变化是
(4)实验中观察到装有淀粉-KI溶液的洗气瓶中的颜色由无色变蓝色,最后褪色,经测定碘被氧化成+5价,写出有关离子方程式:
分析:(1)信息给出浓硫酸能与二氧化锰反应生成氧气,反应方程式可根据电子守恒、原子守恒写出;
(2)实验的组装顺序一般是:发生装置、洗气装置、检验装置、尾气处理装置等,所以该实验的流程为:A装置产生氯气→饱和食盐水除去混有的氯化氢(B装置)→通入石蕊试液(B装置)→通入淀粉碘化钾溶液(B装置)→通入浓硫酸溶液干燥氯气(B装置)→通入干燥的有色布条(D装置)→通入氢氧化钠溶液(B装置)→收集氧气(C装置);氯气具有强氧化性,能将碘离子氧化生成碘单质,氯气能把碘单质氧化生成碘酸.
(2)实验的组装顺序一般是:发生装置、洗气装置、检验装置、尾气处理装置等,所以该实验的流程为:A装置产生氯气→饱和食盐水除去混有的氯化氢(B装置)→通入石蕊试液(B装置)→通入淀粉碘化钾溶液(B装置)→通入浓硫酸溶液干燥氯气(B装置)→通入干燥的有色布条(D装置)→通入氢氧化钠溶液(B装置)→收集氧气(C装置);氯气具有强氧化性,能将碘离子氧化生成碘单质,氯气能把碘单质氧化生成碘酸.
解答:解:(1)根据题给信息知,在加热条件下,浓硫酸和二氧化锰反应生成硫酸锰、氧气和水,反应方程式为:2Mn02+2H2SO4(浓)
2MnSO4+O2↑+2H20,
故答案为:2Mn02+2H2SO4(浓)
2MnSO4+O2↑+2H20;
(2)从实验目的结合所供试剂知,A装置产生氯气→饱和食盐水除去混有的氯化氢(B装置)→通入石蕊试液检验氯气使紫色石蕊试液变色实验(B装置)→通入淀粉碘化钾溶液验证氯气的氧化性比碘单质的氧化性强的实验(B装置)→通入浓硫酸溶液干燥氯气(B装置)→通入干燥的有色布条做氯气是否具有漂白性实验(D装置)→通入氢氧化钠溶液做尾气处理(B装置)→用向上排空气法收集氧气(C装置),
将C收集的气体用带火星的木条检验,如果带火星的木条复燃,则证明是氧气,
故答案为:
将C收集的气体用带火星的木条检验,如果带火星的木条复燃,则证明是氧气;
(3)氯气和水反应生成盐酸和次氯酸,所以其溶液呈酸性,紫色石蕊试液遇酸变红色,次氯酸有漂白性,能使红色褪去,氯气的水溶液呈黄绿色,所以实验中观察装有紫色石蕊试液的洗气瓶中的颜色变化是紫色→红色→无色→黄绿色,
故答案为:紫色→红色→无色→黄绿色;
(4)从实验现象知,氯气向将碘离子氧化生成碘单质,反应方程式为:Cl2+2I-=I2+2Cl-,继续通入氯气,氯气能够将碘氧化为碘酸,反应方程式为:5Cl2+I2+6H2O=12H++IO3-+10Cl-,
故答案为:Cl2+2I-=I2+2Cl-,5Cl2+I2+6H2O=12H++IO3-+10Cl-.
| ||
故答案为:2Mn02+2H2SO4(浓)
| ||
(2)从实验目的结合所供试剂知,A装置产生氯气→饱和食盐水除去混有的氯化氢(B装置)→通入石蕊试液检验氯气使紫色石蕊试液变色实验(B装置)→通入淀粉碘化钾溶液验证氯气的氧化性比碘单质的氧化性强的实验(B装置)→通入浓硫酸溶液干燥氯气(B装置)→通入干燥的有色布条做氯气是否具有漂白性实验(D装置)→通入氢氧化钠溶液做尾气处理(B装置)→用向上排空气法收集氧气(C装置),
将C收集的气体用带火星的木条检验,如果带火星的木条复燃,则证明是氧气,
故答案为:
| 选用的仪器 | 加入试剂 |
| A | 食盐粉末、二氧化锰、浓硫酸 |
| B | 饱和食盐水 |
| B | 紫色石蕊试液 |
| B | 淀粉-KI溶液 |
| B | 浓硫酸 |
| D | 干燥的有色布条 |
| B | 氢氧化钠溶液 |
| C | 无 |
(3)氯气和水反应生成盐酸和次氯酸,所以其溶液呈酸性,紫色石蕊试液遇酸变红色,次氯酸有漂白性,能使红色褪去,氯气的水溶液呈黄绿色,所以实验中观察装有紫色石蕊试液的洗气瓶中的颜色变化是紫色→红色→无色→黄绿色,
故答案为:紫色→红色→无色→黄绿色;
(4)从实验现象知,氯气向将碘离子氧化生成碘单质,反应方程式为:Cl2+2I-=I2+2Cl-,继续通入氯气,氯气能够将碘氧化为碘酸,反应方程式为:5Cl2+I2+6H2O=12H++IO3-+10Cl-,
故答案为:Cl2+2I-=I2+2Cl-,5Cl2+I2+6H2O=12H++IO3-+10Cl-.
点评:本题考查了氯气的实验室制法及性质实验方案的设计,明确氯气的性质是解本题关键,难点是实验方案的设计,根据“发生装置、洗气装置、检验装置、尾气处理装置等”来设计实验即可,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目