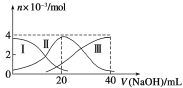
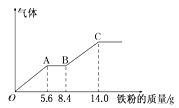
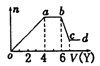题目内容
【题目】I.某实验小组用如图所示的实验装置验证S、C、Si三种元素的非金属性强弱。
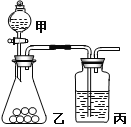
(1)仪器甲的名称为 ,甲中所盛试剂的化学式为 。
(2)乙中盛有白色粉末,可观察到的现象为 。
(3)丙中发生反应的离子方程式为 。
II.另一实验小组用该套装置验证氧化性 KMnO4>Cl2>I2 (已知高锰酸钾常温下可氧化浓盐酸生成氯气)。
(4)写出乙中发生反应的离子方程式: 。
(5)丙中盛有KI溶液和苯的混合物,丙中观察到的现象为 。
【答案】Ⅰ.(1)分液漏斗,H2SO4;(2)固体溶解,并产生大量气泡;(3)CO2+H2O+SiO32-=H2SiO3↓+CO32-;Ⅱ.(4)2MnO4-+10Cl-+16H+=5Cl2↑+8H2O+2Mn2+;(5)上层溶液变为紫红色。
【解析】试题分析:I.(1)仪器甲为分液漏斗,验证三者的非金属性,是验证三者最高价氧化物对应水化物的酸性,酸性越强,其非金属性越强,因此甲中盛放的是H2SO4;(2)固体溶解,产生大量的气泡;(3)丙中盛放的Na2SiO3溶液,因此有CO2+SiO32-+H2O=H2SiO3↓+CO32-;II.(4)利用高锰酸钾的强氧化性,根据信息,Mn的化合价由+7→+2,Cl由-1→0,根据化合价升降法,进行配平,离子反应方程式为2MnO4-+10Cl-+16H+=5Cl2↑+8H2O+2Mn2+;(5)Cl2+2I-=2Cl-+I2,利用I2易溶于有机溶剂,且苯的密度小于水,出现分层,且上层为紫红色。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目