题目内容
8.某小组为研究原电池工作原理,设计如图装置实验. 下列叙述正确的是( )
| A. | 导线中电流方向:锌→铜 | B. | Zn为正极,Cu为负极 | ||
| C. | 溶液中H+向锌片移动 | D. | 该装置能将化学能转变为电能 |
分析 铜锌原电池中,锌较活泼,为原电池的负极,发生Zn-2e-=Zn2+,铜为正极,发生2H++2e-=H2↑,原电池工作时,电子从电池负极经外电路流向正极,以此解答该题.
解答 解:A.在外电路中,电流从正极流向负极,即导线中电流方向:铜→锌,故A错误;
B.铜锌原电池中,锌较活泼,为原电池的负极,铜为正极,故B错误;
C.在溶液中,阳离子往正极移动,H+移向Cu液,故C错误;
D.该装置是原电池,能将化学能转变为电能,故D正确;
故选:D.
点评 本题考查化学反应与原电池反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,难度不大.

练习册系列答案
相关题目
18.某分子式为C10H20O2的酯,在一定条件下可发生如图所示的转化过程:
则符合上述条件的酯的结构可有( )

则符合上述条件的酯的结构可有( )
| A. | 4种 | B. | 8种 | C. | 16种 | D. | 32种 |
19.下列叙述正确的是( )
| A. | 聚氯乙烯与乙烯性质相似,可使溴水褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | C4H9Cl有4种同分异构体 | |
| D. | 分子式为C3H6、C6H12的两种有机物一定是同系物 |
16.下列选项中能发生化学反应,且甲组为取代反应、乙组为加成反应的是( )
| 甲 | 乙 | |
| A | 苯与溴水 | 乙烯与水制乙醇(催化剂) |
| B | 甲烷与氯气(在光亮处) | 乙酸和乙醇的酯化反应(催化剂、加热) |
| C | 乙酸乙酯与氢氧化钠溶液 | 苯与氢气合成环己烷(催化剂,加热) |
| D | 乙烯与溴的四氯化碳溶液 | 乙醇与钠反应 |
| A. | A | B. | B | C. | C | D. | D |
3.一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,则乙可能是( )


| A. | Al(OH)3 | B. | H2SiO3 | C. | CuO | D. | CH3C1 |
13.某研究小组设计的下列实验合理的是( )
| A. |  石油的分馏 | B. |  验证碳酸的酸性强于硅酸 | ||
| C. |  组装原电池 | D. |  乙酸乙酯的制备 |
20.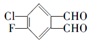 分子被称为“福禄双全宝宝”.苯环上连一个氟原子、一个氯原子、两个邻位醛基的其他“福禄双全宝宝”还有几种( )
分子被称为“福禄双全宝宝”.苯环上连一个氟原子、一个氯原子、两个邻位醛基的其他“福禄双全宝宝”还有几种( )
 分子被称为“福禄双全宝宝”.苯环上连一个氟原子、一个氯原子、两个邻位醛基的其他“福禄双全宝宝”还有几种( )
分子被称为“福禄双全宝宝”.苯环上连一个氟原子、一个氯原子、两个邻位醛基的其他“福禄双全宝宝”还有几种( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
17.某含C、H、O三种元素的未知物X,经实验测定该物质中元素的质量分数为碳72.0%,氢6.67%.另测得
X的相对分子质量为150.下列关于X的说法正确的是( )
X的相对分子质量为150.下列关于X的说法正确的是( )
| A. | 实验式和分子式均为C9H10O | |
| B. | 不可能含有苯环 | |
| C. | 1molX完全燃烧,可生成5mol水 | |
| D. | 若未测得X的相对分子质量,也能确定X的分子式 |
18.下列有关说法正确的是( )
| A. | CuS、FeS、SO3、FeCl2均可由单质直接化合生成 | |
| B. | 硫在空气中的燃烧产物是SO2,在纯氧中的燃烧产物是SO3 | |
| C. | SO2使酸性KMnO4溶液褪色的原因是因为SO2具有还原性 | |
| D. | SO2和O2按物质的量之比2:1通入密闭容器中充分反应后,容器中只有SO3 |