题目内容
15.下列说法正确的是( )| A. | 当7.8 g Na2O2与H2O完全反应时,有0.2 mol电子发生了转移 | |
| B. | FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| C. | 用浓盐酸酸化KMnO4溶液以增强其氧化性 | |
| D. | 在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为2:1 |
分析 A.若有2 mol Na2O2参加反应,则转移电子的物质的量为2mol×(1-0)=2 mol,则1molNa2O2完全反应时转移电子1mol;
B.FeCl2溶液与K3[Fe(CN)6]溶液混合后得到蓝色沉淀,为特征反应;
C.高锰酸钾可氧化HCl;
D.3NO2+H2O=2HNO3+NO中,只有N元素的化合价变化,1molN得到电子与2molN失去电子相同.
解答 解:A.7.8 gNa2O2的物质的量为$\frac{7.8g}{78g/mol}$=0.1mol,与H2O完全反应时,有0.1 mol电子发生了转移,故A错误;
B.FeCl2溶液与K3[Fe(CN)6]溶液混合后得到蓝色沉淀,为特征反应,则可利用此反应检验Fe2+,故B正确;
C.高锰酸钾可氧化HCl,不能利用盐酸酸化,可选硫酸酸化,故C错误;
D.3NO2+H2O=2HNO3+NO中,只有N元素的化合价变化,1molN得到电子与2molN失去电子相同,则氧化剂和还原剂均为NO2,其质量比为1:2,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
5.下列关于F、Cl、Br、I的比较,说法不正确的是( )
| A. | 原子最外层的电子数随核电荷数的增加而增多 | |
| B. | 单质颜色随核电荷数的增加而加深 | |
| C. | 氢化物的稳定性随核电荷数的增加而减弱 | |
| D. | 非金属性随核电荷数的增加而减弱 |
6.下列物质中属于复合材料的是( )
| A. | 水泥 | B. | 玻璃 | C. | 陶瓷 | D. | 玻璃钢 |
3.已知,下列反应均能发生
①2FeCl3+2KI═2FeCl2+2KCl+I2
②2FeCl2+Cl2═2FeCl3
③I2+SO2+2H2O═H2SO4+2HI
判断下列物质氧化能力由强到弱的顺序正确的是( )
①2FeCl3+2KI═2FeCl2+2KCl+I2
②2FeCl2+Cl2═2FeCl3
③I2+SO2+2H2O═H2SO4+2HI
判断下列物质氧化能力由强到弱的顺序正确的是( )
| A. | I->Fe2+>Cl->SO2 | B. | Cl2>Fe3+>I2>SO2 | C. | Fe2+>I->Cl->SO2 | D. | Cl2>Fe3+>SO2>I2 |
10.某温度下,关于①0.01mol/L 醋酸溶液,②pH=2的醋酸溶液,下列说法正确的是( )
| A. | c(CH3COOH):①>② | B. | c(CH3COO-):①>② | ||
| C. | c(CH3COOH)+c(CH3COO-):①=② | D. | c(CH3COO-)+c(OH-):①<② |
20.下列说法不正确的是( )
| A. | 物质的量是用来研究微观粒子的一个国际基本物理量,其单位是摩尔 | |
| B. | 气体的摩尔体积与温度和压强有关,压强越大,体积越小 | |
| C. | 若x个N(氮)原子的质量是1克,则阿佛加德罗常数可表示为28xmol-1 | |
| D. | 任何一种微观粒子,当摩尔质量以g/mol为单位时,其数值与这种粒子的相对分子质量或相对原子质量相同 |
7.2.16g X2O5中含有0.1mol氧原子,则X的摩尔质量为( )
| A. | 28 | B. | 28 g•mol-1 | C. | 14 | D. | 14 g•mol-1 |
4.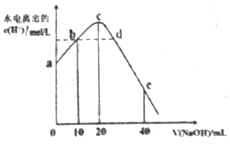 常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )
常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )
 常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )
常温下,向20ml0.01mol•L-1CH3COOH溶液中逐滴加入0.01mol•L-1的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如图所示,下列说法不正确的是( )| A. | 从a到c,醋酸的电离始终受到促进 | |
| B. | 从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点 | |
| C. | b点:2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | a、d对应的纵坐标数值分别是:>10-12、>10-7 |
5.根据下列实验事实,不能得到相应结论的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 常温下分别测等体积、等浓度的醋酸和氨水pH,发现二者的pH 之和为14 | 常温下,醋酸和氨水的电离平衡常数相等 |
| B | 向均盛有2mL5% H2O2 溶液的两支试管中分别滴入0.2mol•L-1 FeCl3,和0.3mol.L-1CuCl2 溶lmL,前者生成气泡的速率更快 | 催化效果:Fe3+>Cu2+ |
| C | 向一定浓度的醋酸溶液中加入镁条,产生气泡的速率会先加快再减慢 | 反应刚开始时,醋酸电离平衡正移,c(H+)增大 |
| D | 向硼酸(H3BO3)溶液中滴加少量Na2CO3溶液,观察到无明显现象. | H3BO3的酸性弱于H2CO3 |
| A. | A | B. | B | C. | C | D. | D |