题目内容
【题目】“低碳生活”是生态文明的前提和基础,减少二氧化碳的排放是“低碳”的一个重要方面,因此,二氧化碳的减排已引起国际社会的广泛关注。请回答下面二氧化碳回收利用的有关问题:
I.利用太阳能等可再生能源,通过光催化、光电催化或电解水制氢来进行二氧化碳加氢制甲醇时发生的主要反应是:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
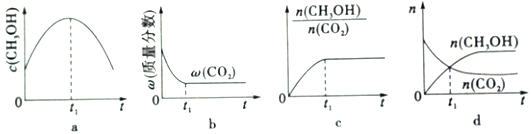
(1)若二氧化碳加氢制甲醇反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到1,时刻达到平衡状态的是____________(填字母编号)
(2)常压下,二氧化碳加氢制甲醇反应时的能量变化如图1所示,则该反应的△H=_____。
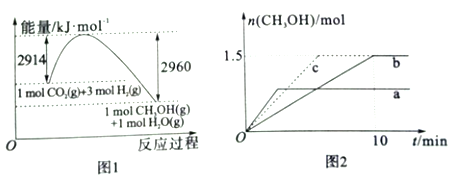
(3)在2L恒容密闭容器a和b中分别投入2molCO2和6molH2在不同温度下进行二氧化碳加氢制甲醇反应,各容器中甲醇的物质的量与时间关系如图2所示:
①若实验a、实验b的反应温度分别为T1、T2,则判断T1_____T2 (选填”>”、“<”或“=”)。若实验b中改变条件时,反应情况会由曲线b变为曲线c,则改变的条件是________。
②计算实验b条件下,0--10min段氢气的平均反应速率v(H2)=_____mol/(L·min)。
③在实验b条件下,该反应的平衡常数为_________。若平衡时向容器再充入1molCO2和3molH2,重新达平衡时,混合气体中甲醇的物质的量分数______30%(选填“>”“<”或“=”)。
II.右图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。
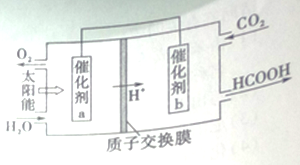
(4)催化剂a表面发生的电极反应式_________。
(5)标准状况下每回收44.8LCO2转移的的电子数为_______个。
(6)常温下,0.1mol/L的HCOONa溶液的pH为10,则常温下,HCOOH的电离常数Ka约为__________。
【答案】 bc -46kJ·mol-1 > 加入催化剂 0.225 ![]() (或5.33) > 2H2O - 4e- == O2↑+4H+ 2.408×1024(或4NA) 10-7
(或5.33) > 2H2O - 4e- == O2↑+4H+ 2.408×1024(或4NA) 10-7
【解析】(1)a、t1甲醇的溶液仍在变小,故错误;b、t1时二氧化碳的质量分数保持恒定,说明反应达到平衡,故正确;c、t1时,甲醇与二氧化碳的物质的量之比保持恒定,达到平衡,故正确;d、t1时二氧化碳在减小,甲醇在增加,故末达到平衡,故错误,故选bc。(2)常压下,二氧化碳加氢制甲醇反应时的能量变化,该反应的△H= 2914kJ·mol-1-2960kJ·mol-1=-46kJ·mol-1 ;(3)①若实验a、实验b的反应温度分别为T1、T2,a先达到平衡,对应的温度高,则判断T1>T2 ;若实验b中改变条件时,反应情况会由曲线b变为曲线c,平衡不移动,则改变的条件是加入催化剂;②计算实验b条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),平衡时甲醇的物质的量为1.5mol,氢气的变化量为4.5mol,0--10min段氢气的平均反应速率v(H2)=
CH3OH(g)+H2O(g),平衡时甲醇的物质的量为1.5mol,氢气的变化量为4.5mol,0--10min段氢气的平均反应速率v(H2)=![]() = 0.225mol/(L·min)。③在实验b条件下,
= 0.225mol/(L·min)。③在实验b条件下,
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
n始/mol 2 6
n变/mol 1.5 4.5 1.5 1.5
n平/mol 0.5 1.5 1.5 1.5
c平/mol·L-1 0.25 0.75 0.75 0.75
该反应的平衡常数为![]() =5.33。若平衡时向容器再充入1molCO2和3molH2,相当于加压,平衡正向移动,重新达平衡时,混合气体中甲醇的物质的量分数>30%。(4)催化剂a表面由图可知水失电子生成氧气,发生的电极反应式: 2H2O - 4e- == O2↑+4H+ ;(5)HCOOH中碳为+2价,CO2中碳为+4价,标准状况下每回收44.8LCO2转移的的电子数为
=5.33。若平衡时向容器再充入1molCO2和3molH2,相当于加压,平衡正向移动,重新达平衡时,混合气体中甲醇的物质的量分数>30%。(4)催化剂a表面由图可知水失电子生成氧气,发生的电极反应式: 2H2O - 4e- == O2↑+4H+ ;(5)HCOOH中碳为+2价,CO2中碳为+4价,标准状况下每回收44.8LCO2转移的的电子数为![]() =2.408×1024个。(6)常温下,0.1mol·L-1的HCOONa溶液pH为10,溶液中存在HCOO-水解HCOO-+H2O
=2.408×1024个。(6)常温下,0.1mol·L-1的HCOONa溶液pH为10,溶液中存在HCOO-水解HCOO-+H2O![]() HCOOH+OH-,故Kh=
HCOOH+OH-,故Kh=![]() =10-7,则HCOOH的电离常数Ka=Kw/Kh=10-14/10-7=10-7。
=10-7,则HCOOH的电离常数Ka=Kw/Kh=10-14/10-7=10-7。

【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO |
|
|
电离平衡常数 |
|
|
|
|
(1)室温下![]()
![]()
![]()
![]()
![]() 溶液的pH由大到小的关系为______.
溶液的pH由大到小的关系为______.
(2)浓度均为![]() 的
的![]() 和
和![]() 的混合溶液中,
的混合溶液中, ![]() 、
、![]() 、
、![]() 、
、![]() 浓度从大到小的顺序为______.
浓度从大到小的顺序为______.
(3)少量![]() 通入到过量的NaClO溶液中发生反应的离子方程式______.
通入到过量的NaClO溶液中发生反应的离子方程式______.
(4)常温下, ![]() 的HCOOH溶液与
的HCOOH溶液与![]() 的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为______.
的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为______.