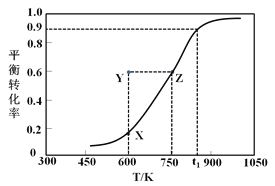
ћвƒњƒЏ»Ё
°Њћвƒњ°њ“їґ®ќ¬ґ»ѕ¬£ђ‘Џ1LЇг»Ё√№±’»Ё∆ч÷–Љ”»лlmolµƒN2(g)ЇЌ3molH2(g)ЈҐ…ъЈі”¶£ЇN2(g)+3H2(g) ![]() 2NH3(g) °чH<0£ђ NH3µƒќп÷ µƒЅњ”л ±ЉдµƒєЎѕµ»зѕ¬±нЋщ Њ£ђѕ¬Ѕ–ЋµЈ®інќуµƒ «
2NH3(g) °чH<0£ђ NH3µƒќп÷ µƒЅњ”л ±ЉдµƒєЎѕµ»зѕ¬±нЋщ Њ£ђѕ¬Ѕ–ЋµЈ®інќуµƒ «
±Љд(min) | 0 | t1 | t2 | t3 |
NH3ќп÷ µƒЅњ(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min£ђv(NH3)=![]() mol°§L-1°§min-1
mol°§L-1°§min-1
B. …эЄяќ¬ґ»£ђњ… є’эЈі”¶Ћў¬ Љх–°£ђƒжЈі”¶Ћў¬ ‘ціу£ђє ∆љЇвƒж“∆
C. N2(g)+3H2(g) ![]() 2NH3(g)µƒїоїѓƒ№–°”Џ2NH3(g)
2NH3(g)µƒїоїѓƒ№–°”Џ2NH3(g) ![]() N2(g)+3H2(g)µƒїоїѓƒ№
N2(g)+3H2(g)µƒїоїѓƒ№
D. t3 ±‘ўЉ”»л1molµƒN2(g)ЇЌ3molH2(g)£ђЈі”¶іп–¬∆љЇв ±£ђc(N2)>0.85mol°§L-1
°Њір∞Є°њB
°Њљвќц°њA£Ѓ0t1min£ђv(NH3)= 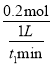 =
=![]() mol°§L-1°§min-1£ђє A’э»Ј£їB£Ѓ…эЄяќ¬ґ»£ђ’э°ҐƒжЈі”¶Ћў¬ Њщ‘ціу£ђє Bінќу£їC£ЃN2(g)+3H2(g)
mol°§L-1°§min-1£ђє A’э»Ј£їB£Ѓ…эЄяќ¬ґ»£ђ’э°ҐƒжЈі”¶Ћў¬ Њщ‘ціу£ђє Bінќу£їC£ЃN2(g)+3H2(g) ![]() 2NH3(g) «Ј≈»»Јі”¶£ђ‘т’эЈі”¶µƒїоїѓƒ№–°”ЏƒжЈі”¶µƒїоїѓƒ№£ђє C’э»Ј£їD£Ѓ1molµƒN2(g)ЇЌ3molH2(g)£ђЈі”¶іп–¬∆љЇв ±£ђNH3(g)µƒ±дїѓЅњќ™0.3mol£ђ‘тN2µƒ±дїѓЅњќ™0.15mol£ђ∆љЇв ±c(N2)=0.85mol°§L-1£ђ‘ўЉ”»л1molµƒN2(g)ЇЌ3molH2(g)£ђ∆љЇв’эѕт“∆ґѓ£ђЄщЊЁј’ѕƒћЎЅ–‘≠јн£ђЈі”¶іп–¬∆љЇв ±£ђc(N2)>0.85mol°§L-1£ђє D’э»Ј£їір∞Єќ™B°£
2NH3(g) «Ј≈»»Јі”¶£ђ‘т’эЈі”¶µƒїоїѓƒ№–°”ЏƒжЈі”¶µƒїоїѓƒ№£ђє C’э»Ј£їD£Ѓ1molµƒN2(g)ЇЌ3molH2(g)£ђЈі”¶іп–¬∆љЇв ±£ђNH3(g)µƒ±дїѓЅњќ™0.3mol£ђ‘тN2µƒ±дїѓЅњќ™0.15mol£ђ∆љЇв ±c(N2)=0.85mol°§L-1£ђ‘ўЉ”»л1molµƒN2(g)ЇЌ3molH2(g)£ђ∆љЇв’эѕт“∆ґѓ£ђЄщЊЁј’ѕƒћЎЅ–‘≠јн£ђЈі”¶іп–¬∆љЇв ±£ђc(N2)>0.85mol°§L-1£ђє D’э»Ј£їір∞Єќ™B°£

 њЏЋгћвњ®±±Њ©ЄЊ≈ЃґщЌѓ≥ц∞ж…зѕµЅ–ір∞Є
њЏЋгћвњ®±±Њ©ЄЊ≈ЃґщЌѓ≥ц∞ж…зѕµЅ–ір∞Є°Њћвƒњ°њ£®11Ј÷£©‘Џ2L√№±’»Ё∆чƒЏ£ђ800°ж ±Јі”¶£Ї2NO(g)+O2(g) ![]() 2NO2(g)ћеѕµ÷–£ђn(NO)Ћж ±Љдµƒ±дїѓ»з±н£Ї
2NO2(g)ћеѕµ÷–£ђn(NO)Ћж ±Љдµƒ±дїѓ»з±н£Ї
±Љд(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
£®1£©іп∆љЇвµƒ ±Љд « £ђјн”… « °£
£®2£©”“ЌЉ÷–±н ЊNO2µƒ±дїѓµƒ«ъѕя « °£”√O2±н Њі”0~2 sƒЏЄ√Јі”¶µƒ∆љЊщЋў¬ v= °£
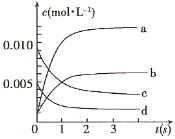
£®3£©ƒ№Ћµ√чЄ√Јі”¶“—іпµљ∆љЇв„іћђµƒ « °£
a£Ѓv(NO2) = 2v(O2) b£Ѓ»Ё∆чƒЏЄчќп÷ µƒ≈®ґ»±£≥÷≤ї±д
c£Ѓvƒж(NO) = 2v’э(O2) d£Ѓіпµљїѓ—І∆љЇв ±£ђNOљЂЌк»Ђ„™їѓќ™NO2
£®4£©ƒ№‘ціуЄ√Јі”¶µƒЈі”¶Ћў¬ « °£
a£ЃЉ∞ ±Ј÷јл≥эNO2∆шће b£Ѓ µ±…эЄяќ¬ґ»
c£Ѓ‘ціуO2µƒ≈®ґ» d£Ѓ—°‘сЄя–ІіяїѓЉЅ