题目内容
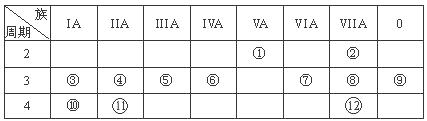
(10分)下表为元素周期表的一部分,请回答有关问题:
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | | ② | |
| 3 | | ③ | ④ | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
(2)表中最活泼的金属是 ,非金属性最强的元素是 。(填元素符号)
(3)表中能形成两性氢氧化物的元素是 ,分别写出该元素形成的单质与⑥、⑨最高价氧化物的水化物反应的化学方程式: 、 。
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱: 。
(1)Si Ar (2)K F
(3)Al;2Al+3H2SO4=Al2(SO4)3+3H2↑,2Al+2KOH+2H2O=2KAlO2+3H2↑
(4)将⑦形成的单质Cl2通入⑩的钠盐NaBr溶液中,加入CCl4震荡后静置,看四氯化碳层是否呈橙红色,若呈橙红色,则说明Cl2的氧化性大于Br2(合理即可)
解析试题分析:(1)从5在元素周期表中的位置第三周期第ⅣA族可知⑤为元素硅Si;从8在元素周期表中的位置第三周期零族可知⑧为元素氩Ar。
(2)表中最活泼的金属应从元素周期表的左下角去找⑨应为元素钾K.非金属性最强的元素应从元素周期表的右上角去找,②应为元素氟F。
(3)表中能形成两性氢氧化物的元素是④元素铝Al,⑥元素为S最高价氧化物的水化物为H2SO4,Al与硫酸反应的化学方程式为:2Al+3H2SO4=Al2(SO4)3+3H2↑;Al与KOH溶液反应的化学方程式为:2Al+2KOH+2H2O=2KAlO2+3H2↑。
(4)元素⑦为氯,元素⑩为溴,氯单质将溴离子氧化为溴单质就能证明氯化溴的氧化性强,所以实验方案为:将Cl2通入NaBr溶液中,加入CCl4震荡后静置,看四氯化碳层是否呈橙红色,若呈橙红色,则说明Cl2的氧化性大于Br2。
考点:本题考查元素的推断、化学方程式的书写、氧化性强弱的比较。

X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
| A.XH4 | B.XH3 | C.H2X | D.HX |
下列各选项中两种粒子所含电子数不相等的是
| A.羟甲基(-CH2OH)和甲氧基(CH3O-) |
| B.羟基(-OH)和氢氧根(OH-) |
| C.硝基(-NO2)和二氧化氮(NO2) |
| D.亚硝酸(HNO2)和亚硝酸根(NO2—) |
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
| A.原子半径的大小顺序: Y<Z<W<X |
| B.化合物YX、ZX2、WX3中化学键的类型相同 |
| C.非金属性的强弱顺序:X>W>Z |
| D.元素W的最高价氧化物对应水化物的酸性比Z的弱 |
元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | | | |
(1)元素⑦在元素周期表的位置为______________,
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为 。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式__________________________________。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为_____________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答:

①E的电子式为 。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为 g。
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑤ | | ⑥ | | |
| 3 | ① | ③ | ④ | | | | ⑦ | ⑨ |
| 4 | ② | | | | | | ⑧ | |
(2)在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是 (填化学式)。
(3)①、②、③三种元素按离子半径由大到小的顺序依次为 (填离子符号)。
(4)⑥元素形成的具有强氧化性的氢化物结构式是 , 该元素另一种氢化物在常温下与②发生反应的化学方程式为 。
(12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
下表为元素周期表的一部分,其中的字母代表相应的元素。
| a | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | b | c | d | | |
| | e | | | | | | | | | | | f | | g | | | |
| | | | | | | | | h | I | | | | | | | | |
(2)元素c、d、e、f的第一电离能(I1)由小到大的顺序为 。(用相应元素的元素符号表示)
(3)表中所列的元素之间可以形成多种无机化合物和有机化合物,则它们形成的化合物之一——邻甲基苯甲醛的分子中碳原子轨道的杂化类型为 。
1 mol 苯甲醛分子中含有σ键的数目为 。
(4)元素d与e形成的化合物常用于制作 材料,其原因是 。
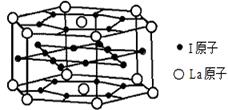
(5)表中有关元素形成的一种离子和单质d3互为等电子体,则该离子的化学式为 。
(6)元素I的合金可用来储存a的单质,该合金的晶胞结构如图所示,则此合金的化学式为 。