题目内容
4.同一条件下,下列关系不正确的是( )| A. | 在水中的溶解度:丙三醇>HOCH2CH2CH2OH>CH3CH2CH2OH>CH2CH2COOCH3 | |
| B. | 密度:CCl4>CHCl3>H2O>苯 | |
| C. | 熔点:2,2-二甲基戊烷>2,3-二甲基丁烷>戊烷>丙烷 | |
| D. | 与金属钠反应的剧烈程度:乙酸>苯酚>乙醇>水 |
分析 A.含-OH越多,溶解性越大,酯不溶于水;
B.液态有机物密度比水小的有烃(烷、烯、炔、芳香烃)、低级酯、一氯代烃、乙醇、乙醛等;密度比水大的有硝基苯、溴苯、四氯化碳、氯仿、溴代烃、乙二醇、丙三醇等,烷、烯、炔等烃类同系物相对密度随着分子内碳原子数的增加的而增大;一氯代烷的相对密度随着碳原子数的增加而减小;
C.烷烃中碳原子个数越多,沸点越大,碳原子个数相同时,支链越多沸点越低;
D.钠与物质产生氢气的快慢取决于羟基氢的活泼性,即物质的酸性越强,则越容易电离出氢离子,与钠反应生成氢气的速率就越快,据此对各选项中的物质羟基的活泼性、酸性强弱进行比较,然后根据与金属钠反应的剧烈程度由强到弱进行顺序;
解答 解:A.含-OH越多,溶解性越大,酯不溶于水,在水中的溶解度:丙三醇>HOCH2CH2CH2OH>CH3CH2CH2OH>CH2CH2COOCH3,故A正确;
B.密度大小:CCl4>CHCl3>H2O>苯,故B正确;
C.烷烃中碳原子个数越多,沸点越大,碳原子个数相同时,支链越多沸点越低,所以2,2-二甲基戊烷>2,3-二甲基丁烷>戊烷>丙烷,故C正确;
D.乙酸为弱酸,酸性大于碳酸,碳酸酸性大于苯酚,水电离出氢离子,乙醇为非电解质不能电离,羟基活泼性乙酸>苯酚>水>乙醇,与金属钠反应的剧烈程度:乙酸>苯酚>水>乙醇,故D错误;
故选D.
点评 本题是一道综合考查题,考查学生烷烃的沸点比较规律、羟基活泼性比较的规律、密度等知识,题目难度不大.

练习册系列答案
相关题目
15.某溶液中Cl-、Br-、I-离子个数之比为1:2:4,要使它们的个数比为3:2:2,需通入Cl2分子的数目是溶液中Br-数目的( )
| A. | $\frac{1}{5}$ | B. | $\frac{1}{4}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
12.X、Y、Z、W 是原子序数依次增大的短周期主族元素.Y 与 W 同主族,Z 所在的族序数等于周期序数,X、Y 最外层电子数之和为 7;X、Z 原子的电子数总和与 Y、W原子的电子数总和之比为 7:12.下列说法正确的是( )
| A. | 元素 Y 的简单离子半径比 Z 的小 | |
| B. | 元素 Y 的简单气态氢化物的热稳定性比 W 的弱 | |
| C. | 由 X、Y 组成的物质与由 Y、W 组成的物质反应,反应类型可能为氧化还原反应 | |
| D. | 常温下,Z 的单质一定能溶于由 X、Y、W 三种元素组成的化合物的溶液 |
9.由实验测得同物质的量浓度的氢氧化钠溶液和硫酸铜溶液按体积比为1.5:1混合时,可生成一种沉淀物,沉淀后溶液中几乎无铜离子,则该沉淀物的化学式是( )
| A. | Cu(OH)2 | B. | 3Cu(OH)2•CuSO4 | C. | 2Cu(OH)2•CuSO4 | D. | Cu(OH)2•CuSO4 |
16. 某化学兴趣小组利用如图装置进行铝热反应实验,发现生成的铁呈疏松的褐色硬块.小组成员推测主要原因是产物铁含杂质较多,并进一步探究该褐色硬块的组成.请回答下列问题:
某化学兴趣小组利用如图装置进行铝热反应实验,发现生成的铁呈疏松的褐色硬块.小组成员推测主要原因是产物铁含杂质较多,并进一步探究该褐色硬块的组成.请回答下列问题:
(l)铝热反应原理Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe(写化学方程式);试剂A为KClO3或Na2O2(写化学式).实验现象:火星四射,有强光(或放出大量热)、有褐色固体生成.
(2)将褐色硬块处理成粉未状,研究小组首先排除了含有单质Al杂质的可能性.
实验方法:首先取少量粉未加入NaoH溶液中;
实验现象:粉末部分溶解,但没有气泡产生;实验结论是:粉末中含有Al2O3而没有Al.
(3)根据上述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3.提出假设:
假设l:固体粉末中除Al2O3外还有Fe;
假设II:固体粉末中除Al2O3外还有Fe和Fe2O3.
设计方案并实验:
你认为上述结论是否合理,不合理,理由是Fe3O4与酸反应生成的Fe3+与Fe反应生成Fe2+,滴入KSCN溶液后也不变色.
(4)取上述实验所得溶液,滴入适量氯水溶液变红色.此时涉及的离子反应方程式为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-?Fe(SCN)3.
 某化学兴趣小组利用如图装置进行铝热反应实验,发现生成的铁呈疏松的褐色硬块.小组成员推测主要原因是产物铁含杂质较多,并进一步探究该褐色硬块的组成.请回答下列问题:
某化学兴趣小组利用如图装置进行铝热反应实验,发现生成的铁呈疏松的褐色硬块.小组成员推测主要原因是产物铁含杂质较多,并进一步探究该褐色硬块的组成.请回答下列问题:(l)铝热反应原理Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe(写化学方程式);试剂A为KClO3或Na2O2(写化学式).实验现象:火星四射,有强光(或放出大量热)、有褐色固体生成.
(2)将褐色硬块处理成粉未状,研究小组首先排除了含有单质Al杂质的可能性.
实验方法:首先取少量粉未加入NaoH溶液中;
实验现象:粉末部分溶解,但没有气泡产生;实验结论是:粉末中含有Al2O3而没有Al.
(3)根据上述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3.提出假设:
假设l:固体粉末中除Al2O3外还有Fe;
假设II:固体粉末中除Al2O3外还有Fe和Fe2O3.
设计方案并实验:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设II不成立 |
| ②再滴入几滴0.01mol/L KSCN 溶液 | 溶液不变色 |
(4)取上述实验所得溶液,滴入适量氯水溶液变红色.此时涉及的离子反应方程式为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-?Fe(SCN)3.
17.NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 在电解精炼铜时,当电路中通过的电子数为 2NA 时,阳极质量减少 64 g | |
| B. | 标准状况下,11.2 L 苯中含有 C-H 键的数目为 3NA | |
| C. | 常温常压下,1 mol 甲基(-CH3)所含电子数为 10NA | |
| D. | 标准状况下,22.4 L CO 和 C2H4 混合气体的总分子数为 NA,质量为 28 g |
 一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3molH2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2物质的量随时间变化如图所示.回答下列问题:
一定温度下,在体积为2L的恒容密闭容器中充入1molN2和3molH2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2物质的量随时间变化如图所示.回答下列问题:
 ,C中含官能团名称羟基;
,C中含官能团名称羟基; .加聚反应
.加聚反应 某有机物X的键线式为
某有机物X的键线式为 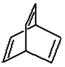
 ,该芳香烃Z在常温常压下与溴水发生反应,写出生成物的结构简式
,该芳香烃Z在常温常压下与溴水发生反应,写出生成物的结构简式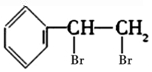 .
.