题目内容
(必修)
欲测定 (NH4)2Fe(SO4)2.xH2O中x值,经讨论有多种实验方案.可供选用的试剂如下:
①1.0mol/L BaCl2 ②0.50mol/L NaOH ③0.26mol/L H2SO4 ④amol/L 酸性KMnO4
实验步骤:
第一步:称取(NH4)2Fe(SO4)2.xH2O样品mg,放入250ml锥形瓶中,加适量水溶解;
第二步:…
请回答下列问题:
(1)据提供的试剂,设计实验方案完成方案2、3的第二步操作,填写下表:
(2)①配制100mLamol/l KMnO4溶液,若将溶液注入容量瓶时有溶液溅在容量瓶外,处理方法是 ;
②用 (填仪器名称)装入一定体积的amol/L高锰酸钾溶液;滴定时发生反应的离子方程式是: ;
③滴定终点时若仰视读数,则X的值 (偏高、偏低).
(3)若用50mL的0.50mol/LNaOH稀溶液和50mL 的0.28mol/L稀H2SO4 测定中和热,则每次实验中除了测定NaOH和稀H2SO4的起始平均温度t1外还需要测定 温度t2.
欲测定 (NH4)2Fe(SO4)2.xH2O中x值,经讨论有多种实验方案.可供选用的试剂如下:
①1.0mol/L BaCl2 ②0.50mol/L NaOH ③0.26mol/L H2SO4 ④amol/L 酸性KMnO4
实验步骤:
第一步:称取(NH4)2Fe(SO4)2.xH2O样品mg,放入250ml锥形瓶中,加适量水溶解;
第二步:…
请回答下列问题:
(1)据提供的试剂,设计实验方案完成方案2、3的第二步操作,填写下表:
| 加入药品: | 操作方法 | 数据处理 | |
| 方案1 | 加过量NaOH溶液 | 加热、干燥NH3,用H2SO4溶液吸收NH3 | 求算NH3质量 |
| 方案2 | 称量 | ||
| 方案3 | 测定 |
②用
③滴定终点时若仰视读数,则X的值
(3)若用50mL的0.50mol/LNaOH稀溶液和50mL 的0.28mol/L稀H2SO4 测定中和热,则每次实验中除了测定NaOH和稀H2SO4的起始平均温度t1外还需要测定
分析:(1)方案2:加入氯化钡溶液,使溶液中的硫酸根离子生成硫酸钡沉淀,过滤洗涤后称量沉淀硫酸钡的质量;
方案3:加入高锰酸钾溶液,通过滴定测定亚铁离子的含量;
(2)①有溶液溅在容量瓶外,溶液配制失败,需要重新配制溶液;
②高锰酸钾溶液具有强氧化性,需要使用酸式滴定管;高锰酸钾能够将亚铁离子氧化成铁离子,发生氧化还原反应;
③滴定终点时若仰视读数,读数偏大,消耗的高锰酸钾溶液体积偏大;
(3)中和热测定公式Q=cm△T,需要知道平均温度t1和最高温度t2.
方案3:加入高锰酸钾溶液,通过滴定测定亚铁离子的含量;
(2)①有溶液溅在容量瓶外,溶液配制失败,需要重新配制溶液;
②高锰酸钾溶液具有强氧化性,需要使用酸式滴定管;高锰酸钾能够将亚铁离子氧化成铁离子,发生氧化还原反应;
③滴定终点时若仰视读数,读数偏大,消耗的高锰酸钾溶液体积偏大;
(3)中和热测定公式Q=cm△T,需要知道平均温度t1和最高温度t2.
解答:解:(1)方案2:加入过量的1.0mol/L氯化钡溶液,使溶液中的硫酸根离子生成硫酸钡沉淀,过滤、洗涤后称量沉淀硫酸钡的质量,
故答案为:加过量BaCl2;过滤、洗涤、干燥BaSO4;称量m(BaSO4) (或者加过量NaOH溶液;过滤、洗涤、灼烧、称量Fe2O3)
方案3:加入a mol/L酸性KMnO4溶液,用a mol/L酸性KMnO4溶液滴定至终点,记录下消耗的高锰酸钾溶液的体积,
故答案为:a mol/L酸性KMnO4溶液; 用a mol/L酸性KMnO4溶液滴定至终点;KMnO4溶液;
(2)①若将溶液注入容量瓶时有溶液溅在容量瓶外,实验操作失败,需要重新配制溶液,故答案为:重新配制;
②高锰酸钾具有氢氧化性,能够氧化橡胶管,不能使用碱式滴定管,所以使用的是酸式滴定管;酸性条件下亚铁离子被高锰酸根离子氧化成铁离子,根据化合价升降相等配平,反应的离子方程式为:5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O,
故答案为:酸式滴定管; 5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O;
③由于滴定终点时若仰视读数,读数偏大,消耗的高锰酸钾溶液体积偏大,测定的铁元素含量偏大,水含量偏低,X的值偏低,故答案为:偏低;
(3)根据中和热测定公式Q=cm△T,求△T需要知道平均温度t1和最高温度t2,故答案为:最高.
故答案为:加过量BaCl2;过滤、洗涤、干燥BaSO4;称量m(BaSO4) (或者加过量NaOH溶液;过滤、洗涤、灼烧、称量Fe2O3)
方案3:加入a mol/L酸性KMnO4溶液,用a mol/L酸性KMnO4溶液滴定至终点,记录下消耗的高锰酸钾溶液的体积,
故答案为:a mol/L酸性KMnO4溶液; 用a mol/L酸性KMnO4溶液滴定至终点;KMnO4溶液;
(2)①若将溶液注入容量瓶时有溶液溅在容量瓶外,实验操作失败,需要重新配制溶液,故答案为:重新配制;
②高锰酸钾具有氢氧化性,能够氧化橡胶管,不能使用碱式滴定管,所以使用的是酸式滴定管;酸性条件下亚铁离子被高锰酸根离子氧化成铁离子,根据化合价升降相等配平,反应的离子方程式为:5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O,
故答案为:酸式滴定管; 5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O;
③由于滴定终点时若仰视读数,读数偏大,消耗的高锰酸钾溶液体积偏大,测定的铁元素含量偏大,水含量偏低,X的值偏低,故答案为:偏低;
(3)根据中和热测定公式Q=cm△T,求△T需要知道平均温度t1和最高温度t2,故答案为:最高.
点评:本题考查了(NH4)2Fe(SO4)2.xH2O中水含量测定,涉及了设计实验方案、仪器选择、误差分析等知识,本题难度中等.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
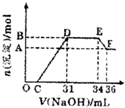 研究发现,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.分析上述图形,下列说法不正确的是( )
研究发现,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.分析上述图形,下列说法不正确的是( )| A、欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量 | B、溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ | C、溶液中n(NH4+)=0.012mol | D、OC段离子反应方程式:H++OH-=H2O |
为了防止环境污染并对尾气进行综合利用,硫酸厂常用两种方法吸收尾气中的SO2、SO3等气体。
方法一:将尾气通入氨水,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。已知(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃,欲测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出,测得有关实验数据以下:
实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
① | 7.24 | 50.0 | 1.792 |
② | 14.48 | 50.00 | 3.584 |
③ | 21.72 | 50.00 | 4.032 |
④ | 28.96 | 50.00 | 3.136 |
(1)若取3.62 g样品用同种方法实验时,生成氨气的体积(标准状况)为__________L。
(2)该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为__________。
(3)求所用NaOH溶液的物质的量浓度(写出计算过程)。
方法二:用NaOH溶液、石灰及O2吸收尾气SO2,以制取石膏(CaSO4·2H2O),此过程的中间产物是NaHSO3。实际操作中以调节尾气排放的流量来取得SO2与NaOH间物质的量的最佳比值,从而提高亚硫酸氢钠的产量。试写出n(SO2)/n(NaOH)在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)的关系式,填入下表:
n(SO2)/n(NaOH) | n(NaHSO3) |
|
|
|
|
|
|
|
|