题目内容
将主族元素X的最高价氧化物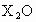 4.7g溶于95.3g水中,所得溶液
4.7g溶于95.3g水中,所得溶液
中溶质的质量分数为5.6%.Y与X在同一主族,12gY的氢氧化物跟400mL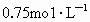 的盐酸恰好中和.Z与Y在同一周期,标准状况下5.6L
的盐酸恰好中和.Z与Y在同一周期,标准状况下5.6L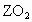 气体的质量为16g.求X、Y、Z的原子量,并分别写出它们的电子式.
气体的质量为16g.求X、Y、Z的原子量,并分别写出它们的电子式.
答案:略
解析:
提示:
解析:
|
X 的原子量为39,电子式K·;Y 的原子量为23,电子式Na·;Z 的原子量为32,电子式 |
提示:
|
由 X的最高价氧化物 可知X为显+1价的金属元素.Y与X同主 可知X为显+1价的金属元素.Y与X同主
族,所以 X、Y均在IA族.设 X的原子量为A,Y的原子量为B
2A +16 2(A+17)4.7g 5.6%(4.7+95.3)g
A=39 X为钾 电子式K·盐酸中 HCl物质的量为
(B +17)g 1 mol12g 0.3 mol
B=23 Y为钠 电子式Na.
 |

练习册系列答案
相关题目





