题目内容
[化学——物质结构与性质]
已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子。请回答下列问题:
(1)E元素基态原子的电子排布式为 。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为 (填元素符号)。
(3)D元素与氟元素相比,电负性:D F(填“>”、“=”或“<”)。
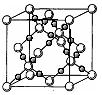
(4)BD2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为 。l mol B2A2分子中含![]() 键的数目是 。
键的数目是 。
(5)光谱证实单质E与强碱溶液反应有[E(OH)4]—生成,则[E(OH)4]—中存在 。
a.共价键 b.配位键 c.σ键 d.π键
(1)1s22s22p6 3s23p1 (2分)
(2)C、O、N (2分)
(3)< (1分)
(4) 原子 sp3 3 NA(或1.806×1024) (各2分)
(5) abc (2分)

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 ”表示该晶体中的一个原子,请在该立方体的顶点上用“
”表示该晶体中的一个原子,请在该立方体的顶点上用“ ”表示出与之紧邻的原子.
”表示出与之紧邻的原子.

 ,平面结构)属于
,平面结构)属于 (2013?菏泽二模)[化学-物质结构与性质]
(2013?菏泽二模)[化学-物质结构与性质]