题目内容
16.水溶液中能大量共存的一组离子是( )| A. | K+、Al3+、NO3-、HCO3- | B. | H+、Na+、Fe2+、ClO- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | K+、NH4+、SO42-、OH- |
分析 根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应,不能发生相互促进水解反应等,则离子大量共存,以此来解答.
解答 解:A.Al3+、HCO3-发生相互促进水解反应,不能大量共存,故A不选;
B.H+、Fe2+、ClO-发生氧化还原反应,不能大量共存,故B不选;
C.该组离子之间不反应,可大量共存,故C选;
D.NH4+、OH-结合生成弱电解质,不能大量共存,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
20.欲制取较纯净的1,2二氯乙烷,可采取的方法是( )
| A. | 乙烯与HCl加成 | |
| B. | 乙烯与Cl2加成 | |
| C. | 乙烷与Cl2按1:2的体积比在光照条件下反应 | |
| D. | 乙烯先与HCl加成,再与等物质的量的Cl2在光照下反应 |
7.化学与生产、生活息息相关,下列叙述错误的是( )
| A. | 除去瓷器表面污垢可以选用热的烧碱溶液 | |
| B. | 溶质质量分数:医用酒精>食醋>生理盐水 | |
| C. | 绚丽缤纷的烟花是因添加了钾、钠、钙、铜等金属元素的焰色反应形成的 | |
| D. | 研制开发燃料电池汽车,降低机动车尾气污染,某种程度上可以减少PM2.5污染 |
4.乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
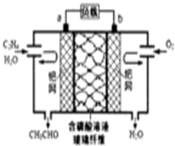

| A. | 每有0.1molO2反应,则迁移H+0.4mol | |
| B. | 该电池为可充电电池 | |
| C. | 电子移动方向:电极a→磷酸溶液→电极b | |
| D. | 正极反应式为:CH2=CH2-2e-+2OH→CH3CHO+H2O |
11.在室温下,下列各组微粒在溶液中能大量共存的是( )
| A. | Na+、Ba2+、NO3-、Cl-、 | B. | H+、Fe2+、ClO-、SO42- | ||
| C. | K+、Fe3+、C6H5O-、SCN- | D. | NH4+、Al3+、SiO32-、CO32- |
1.下列实验操作、现象和解释都正确的是( )
| 选项 | 实验操作 | 现象 | 解释 |
| A | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| B | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 上层呈紫红色,下层有白色沉淀生产 | 铜离子可以氧化碘离子,白色沉淀可能为CuI |
| D | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
8.海洋是地球上最广阔的水体的总称,其含水量约占地球上总水量的97%.
(1)海水中含有许多化学物质,不能直接饮用,所以将海水转化为淡水是一项重大科研课题.电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示,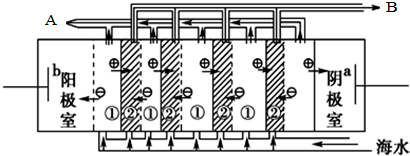 电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.
电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.
(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发池和结晶池,建盐田必须在BC处建立(填写序号).
A.选在离江河入海口比较近的地方B.多风少雨C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe3+、SO42-等离子,流程如下:
粗盐水$\stackrel{过量BaCl_{2}溶液}{→}$$\stackrel{过量Na_{2}CO_{3}溶液}{→}$$\stackrel{过量NaOH溶液}{→}$$\stackrel{过滤}{→}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20°C部分沉淀的溶解度(g)如下表:
①检测Fe3+是否除尽的方法是取过程 III的滤液于试管中,向其中滴加KSCN溶液,若溶液不变色证明Fe3+已经沉淀干净,反之没除净.
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2 和 NH3 为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克
①检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中,加入稀H2SO4溶液(或AgNO3(HNO3)溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀,则沉淀已洗涤干净;
②样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
(1)海水中含有许多化学物质,不能直接饮用,所以将海水转化为淡水是一项重大科研课题.电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示,
 电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.
电渗析法淡化海水时阴极室可获得的重要化工原料有氢气、氢氧化钠.(2)海水中含有大量的NaCl,盐田法仍是目前海水制盐的主要方法.盐田分为贮水池、蒸发池和结晶池,建盐田必须在BC处建立(填写序号).
A.选在离江河入海口比较近的地方B.多风少雨C.潮汐落差大且又平坦空旷的海滩
(3)盐田中所得为粗盐,若想用粗盐制烧碱,需对所用食盐水进行两次精制.第一次精制主要是用沉淀法除去粗盐水中的Ca2+、Mg2+、Fe3+、SO42-等离子,流程如下:
粗盐水$\stackrel{过量BaCl_{2}溶液}{→}$$\stackrel{过量Na_{2}CO_{3}溶液}{→}$$\stackrel{过量NaOH溶液}{→}$$\stackrel{过滤}{→}$滤液$→_{调pH}^{盐酸}$第一次精制食盐水
已知:20°C部分沉淀的溶解度(g)如下表:
| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②运用表中数据解释过程I选用BaCl2而不选用CaCl2的原因BaSO4的溶解度比CaSO4的更小,可将SO42-沉淀的更完全.
(4)工业上通常以NaCl、CO2 和 NH3 为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl.
(5)工业制得的纯碱常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.样品m克$→_{溶解}^{H_{2}O}$溶液$→_{过滤}^{过量BaCl_{2}溶液}$沉淀$→_{洗涤}^{H_{2}O}$$\stackrel{低温烘干、冷却、称量}{→}$固体n克
①检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中,加入稀H2SO4溶液(或AgNO3(HNO3)溶液),若产生白色沉淀,则沉淀没有洗涤干净;若无白色沉淀,则沉淀已洗涤干净;
②样品中NaCl质量分数的数学表达式为(1-$\frac{106n}{197m}$)×100%.
 镍及其化合物应用广泛
镍及其化合物应用广泛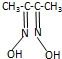 ) 常用于检验Ni:在一定条件下,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图1所示.
) 常用于检验Ni:在一定条件下,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图1所示.