题目内容
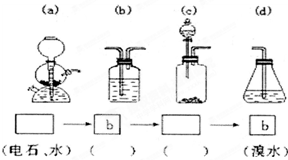 为探究乙炔与溴的加成反应,
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石ag(含CaC290%)与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
乙同学发现甲同学实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还有可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应.请回答问题:
(1)写出甲同学实验中两个主要的化学方程式
(2)乙同学推测此乙炔中必定含有的一种杂质气体是
(3)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品.
(4)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是
(5)如果忽略杂质气体体积,理论上可以产生乙炔的体积为
考点:乙炔的性质实验
专题:实验题
分析:(1)碳化钙能与水反应生成乙炔,乙炔具有不饱和键,能与溴水发生加成反应而使溴水褪色;
(2)电石中含有硫化物,与水反应生成硫化氢气体;
(3)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔;
(4)根据取代反应的特征是:有去有回来回答;
(5)根据方程式计算理论上可以产生乙炔的体积;
(2)电石中含有硫化物,与水反应生成硫化氢气体;
(3)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔;
(4)根据取代反应的特征是:有去有回来回答;
(5)根据方程式计算理论上可以产生乙炔的体积;
解答:
解:(1)碳化钙能与水反应生成乙炔和水,反应方程式为CaC2+2H2O→Ca(OH)2+C2H2↑,乙炔具有不饱和键,能与溴水发生加成反应而使溴水褪色,反应方程式为CH≡CH+2Br2→CHBr2-CHBr2,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;CH≡CH+2Br2→CHBr2-CHBr2;
(2)电石中含有硫化物,与水反应生成硫化氢气体,硫化氢气体具有还原性,能与溴水发生氧化还原反应生成硫和溴化氢,反应方程式为Br2+H2S═S↓+2HBr,
故答案为:H2S;Br2+H2S═S↓+2HBr;
(3)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔,方案为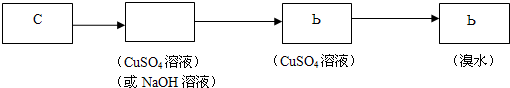 ,
,
故答案为: ;
;
(4)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证;
故答案为:如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证;
(5)根据方程式计算:
CaC2 +H2O═C2H2↑+Ca(OH)2
64g 22.4L
ag×90% VL
=
V=0.315aL,
故答案为:0.315aL.
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;CH≡CH+2Br2→CHBr2-CHBr2;
(2)电石中含有硫化物,与水反应生成硫化氢气体,硫化氢气体具有还原性,能与溴水发生氧化还原反应生成硫和溴化氢,反应方程式为Br2+H2S═S↓+2HBr,
故答案为:H2S;Br2+H2S═S↓+2HBr;
(3)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔,方案为
 ,
,故答案为:
 ;
;(4)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证;
故答案为:如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证;
(5)根据方程式计算:
CaC2 +H2O═C2H2↑+Ca(OH)2
64g 22.4L
ag×90% VL
| 22.4L |
| VL |
| 64g |
| ag×90% |
故答案为:0.315aL.
点评:本题考查了乙炔的制备和性质实验,题目难度不大,本题中注意乙炔的除杂和性质实验,注意与溴水反应的性质.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
下列粒子浓度关系不正确的是( )
| A、Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| B、NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C、pH=2的盐酸与pH=12的氨水以任意比例混合所得溶液中:c(H+)+c(NH4+)=c(OH-)+c(Cl-) |
| D、等物质的量浓度的CH3COOH和CH3COONa溶液等体积混合后所得溶液中:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
下列化学反应的离子方程式,书写正确的是( )
| A、碳酸钙与稀盐酸反应:CO32-+2H+═H2O+CO2↑ |
| B、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| C、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| D、氢氧化铁溶于盐酸:Fe(OH)3+3H+═Fe3++3H2O |
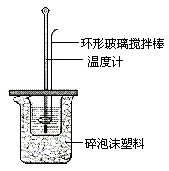 已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题
已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题