题目内容
一定温度下,向一个容积为2L的事先装入催化剂的真空密闭容器中通入1mol N2和3mol H2,3min末测科容器内压强是起始时压强的0.9倍.在此时间内用H2的量的变化来表示该反应的平均反应速率vH2是( )A.0.2mol/
B.0.6mol/
C.0.1mol/
D.0.3mol/
【答案】分析:利用压强之比等于物质的量之比,求出3min末时容器内混合气体的物质的量,据此通过方程式利用差量法计算氢气的物质的量变化量,再利用根据v= 计算v(H2).
计算v(H2).
解答:解:3min末测得容器内压强是起始时压强的0.9倍,压强之比等于物质的量之比,
所以3min末时容器内混合气体的物质的量为(1mol+3mol)×0.9=3.6mol
对反应 3H2+N2 2NH3.物质的量变化△n
2NH3.物质的量变化△n
3 2
△n(H2) 4mol-3.6mol=0.4mol
所以△n(H2)= ×0.4mol=0.6mol.
×0.4mol=0.6mol.
所以3min内,用H2表示的平均反应速率v(H2)= =0.1mol/(L?min).
=0.1mol/(L?min).
故选:C.
点评:考查反应速率的有关计算,难度不大,关键根据压强变化计算参加反应的氢气的物质的量.
 计算v(H2).
计算v(H2).解答:解:3min末测得容器内压强是起始时压强的0.9倍,压强之比等于物质的量之比,
所以3min末时容器内混合气体的物质的量为(1mol+3mol)×0.9=3.6mol
对反应 3H2+N2
 2NH3.物质的量变化△n
2NH3.物质的量变化△n3 2
△n(H2) 4mol-3.6mol=0.4mol
所以△n(H2)=
 ×0.4mol=0.6mol.
×0.4mol=0.6mol.所以3min内,用H2表示的平均反应速率v(H2)=
 =0.1mol/(L?min).
=0.1mol/(L?min).故选:C.
点评:考查反应速率的有关计算,难度不大,关键根据压强变化计算参加反应的氢气的物质的量.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
氮及其化合物与我们的吃、穿、住、行、健康等都有着密切的联系,也是高中化学学习中重要的一部分.请回答下列问题:
(1)一定条件下,向一个2L的密闭容器中充入2molN2和6molH2,反应达平衡时放出93kJ热量,生成NH3的浓度为1mol/L,试写出该反应的热化学方程式 .
(2)现有一支l0mL的试管,充满NO倒置于水槽中,向试管中缓缓通A-定量氧气,当试管内液面稳定时,剩余气体2mL.则通入氧气的体积可能为 .
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2g)?4NO(g)+6H2O(g).
①恒温恒容下,平衡时NH3的转化率甲 乙.(填“>”、“、”或“<”)
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x= ,y= ,z= .
(4)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g)?N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1<T2,则a1 a2.
A.大于 B.小于 c.等于 D.以上都有可能
(5)标准状况下,将干燥纯净的氨和二氧化氮气体分别完成喷泉实验后所得溶液等体积混合,反应后溶液中的离子浓度关系正确的是 .
A.c(NO-3)>c(NH+4)>c(H+)>c(OH-)
B.c(NH+4)>c(NO-3)>c(OH-)>c(H+)
C.c(H+)=c(OH-)+c(NH3.H2O)
D.c(NH4+)+c(NH3.H2O)=1.5c(NO-3)
(1)一定条件下,向一个2L的密闭容器中充入2molN2和6molH2,反应达平衡时放出93kJ热量,生成NH3的浓度为1mol/L,试写出该反应的热化学方程式
(2)现有一支l0mL的试管,充满NO倒置于水槽中,向试管中缓缓通A-定量氧气,当试管内液面稳定时,剩余气体2mL.则通入氧气的体积可能为
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2g)?4NO(g)+6H2O(g).
| 起始浓度(mol. L-1) | c( NH3) | c( O2) | c( NO) | c( H20) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 2 | 4 | 0 | 0 |
| 丙 | 0.5 | x | y | z |
②恒温恒容下,若要使丙与甲平衡时各组分浓度相同,则x=
(4)向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2,发生反应:2NO2(g)?N2O4(g)△H<0.恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1和a2;已知T1<T2,则a1
A.大于 B.小于 c.等于 D.以上都有可能
(5)标准状况下,将干燥纯净的氨和二氧化氮气体分别完成喷泉实验后所得溶液等体积混合,反应后溶液中的离子浓度关系正确的是
A.c(NO-3)>c(NH+4)>c(H+)>c(OH-)
B.c(NH+4)>c(NO-3)>c(OH-)>c(H+)
C.c(H+)=c(OH-)+c(NH3.H2O)
D.c(NH4+)+c(NH3.H2O)=1.5c(NO-3)
 2SO3(g) △H=-196.6 kJ·mol-1
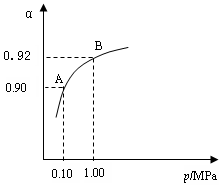
2SO3(g) △H=-196.6 kJ·mol-1 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。