题目内容
5.下列应用或事实与胶体的性质无关的是( )| A. | 阳光透过墙上的小孔在较暗的房间里形成一道道光柱 | |
| B. | 用石膏或盐卤制豆腐 | |
| C. | 向FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 | |
| D. | 长江三角洲的形成 |
分析 A.气溶胶具有丁达尔现象;
B.胶体加入电解质发生聚沉;
C.红褐色沉淀是生成的氢氧化铁,不是胶体;
D.江河入海口三角洲的形成是胶体聚沉的结果.
解答 解:A.阳光透过墙上的小孔在较暗的房间里形成一道道光柱、,是胶体的丁达尔现象,与胶体有关,故A正确;
B.用石膏或盐卤点制豆腐,利用的是胶体的聚沉,和胶体性质有关,故B正确;
C.在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀,发生的是复分解反应,与胶体无关,故C错误;
D.江河中的泥浆属于胶体,江河入海口三角洲的形成是胶体聚沉的结果,和胶体性质有关,故D正确.
故选C.
点评 本题考查了胶体性质的应用,主要考查胶体的聚沉、胶体的分散质微粒直径,丁达尔现象,熟练掌握胶体性质是解题关键,较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | 碳酸钙中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 向NaOH溶液中通入足量CO2:CO2+OH-═HCO3- | |
| C. | FeBr2溶液中通入足量氯气:Fe2++2Br-+2 Cl2═Fe3++Br2+4Cl- | |
| D. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-═Cu(OH)2↓ |
16.可以获得分子中化学键或官能团信息的方法为( )
| A. | 质谱法 | B. | 色谱法 | C. | 红外光谱法 | D. | 核磁共振氢谱法 |
13.节能降耗,保护环境是可持续发展的主要课题.请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实验污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”.下列化学反应不符合“绿色化学”思想的是BD;
A.制备环氧乙烷:2CH2=CH2+O2$\stackrel{催化剂}{→}$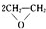
B.制备硫酸铜:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
C.制备甲醇:2CH4+O2$\frac{\underline{催化剂}}{△}$2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因在酸性条件下,CN-与H+结合生成毒性很强的HCN,对人和环境造成危害;
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因.
①从产率和产量角度分析虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多;
②从环境保护和能耗角度分析两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得.
(1)“绿色化学”的最大特点在于它是在始端就采用预防实验污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”.下列化学反应不符合“绿色化学”思想的是BD;
A.制备环氧乙烷:2CH2=CH2+O2$\stackrel{催化剂}{→}$
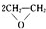
B.制备硫酸铜:Cu+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
C.制备甲醇:2CH4+O2$\frac{\underline{催化剂}}{△}$2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2]-,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因在酸性条件下,CN-与H+结合生成毒性很强的HCN,对人和环境造成危害;
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”.下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
①从产率和产量角度分析虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多;
②从环境保护和能耗角度分析两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得.
20.下列除杂方案错误的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 |
| A | FeCl3(aq) | Al3+(aq) | NaOH溶液、盐酸 |
| B | AlCl3(aq) | Cu2+ | Al粉 |
| C | NaHCO3(aq) | Na2CO3(aq) | CO2气体 |
| D | FeCl3(aq) | Cu2+ | Fe粉 |
| A. | A | B. | B | C. | C | D. | D |
10.向下列溶液中逐渐通入SO2,一直不产生沉淀的是( )
| A. | Ca(OH)2溶液 | B. | CaCl2溶液 | C. | Ba(NO3)2溶液 | D. | H2S的水溶液 |
17.某镁盐溶液中含有杂质离子 Cr3+,所含主要离子及其浓度如下表所示(H+ 和 OH-未列出):
已知 25℃时,Ksp[Cr(OH)3]=10-32;Ksp[Mg (OH)2]=5×10-11;操作过程中溶液体积的变化忽略不计.
(1)表格中的 a>1.03(填“<”、“>”或“=”).
(2)除去杂质Cr3+离子,可加入MgO调节溶液 pH,理论上应调节pH的范围是5≤pH<9.
(3)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2?6H2O)的操作是在HCl氛围中加热浓缩,冷却结晶,过滤.
| 离子 | Mg2+ | Cr3+ | Cl- |
| 浓度(mol/L) | 0.5 | 0.01 | a |
(1)表格中的 a>1.03(填“<”、“>”或“=”).
(2)除去杂质Cr3+离子,可加入MgO调节溶液 pH,理论上应调节pH的范围是5≤pH<9.
(3)溶液经除杂、过滤后,由滤液制取氯化镁晶体(MgCl2?6H2O)的操作是在HCl氛围中加热浓缩,冷却结晶,过滤.
14.欲将 转化为
转化为 ,可以加入( )
,可以加入( )
 转化为
转化为 ,可以加入( )
,可以加入( )| A. | 水 | B. | 碳酸氢钠溶液 | C. | 碳酸 | D. | 盐酸 |