题目内容
常温下,已知相同浓度的碳酸钠溶液中的c(CO32-)比偏铝酸钠溶液中的c(AlO2-)大得多,则下列推论中正确的是( )
分析:相同浓度的碳酸中c(CO32-)比偏铝酸中的c(AlO2-)大得多,这说明HCO3-比HA1O2性强,而H2CO3的酸性强于HCO3-,即酸性:H2CO3>HCO3->HA1O2:
A.根据强酸制弱酸,通入CO2于AlO2-溶液中,先生成氢氧化铝和碳酸钠,CO2过量能与碳酸钠反应生成碳酸氢钠;
B.酸性:HCO3->HA1O2,Al(OH)3即H3AlO3失一个水,得到偏铝酸HA1O2,若产生AlO2-的话,则CO32-变成HCO3-,这就变成了弱酸制强酸;
C.根据酸性越强,电离常数越大;
D.酸性:HCO3->HA1O2,根据强酸制弱酸,HCO3-与A1O2-会发生反应.
A.根据强酸制弱酸,通入CO2于AlO2-溶液中,先生成氢氧化铝和碳酸钠,CO2过量能与碳酸钠反应生成碳酸氢钠;
B.酸性:HCO3->HA1O2,Al(OH)3即H3AlO3失一个水,得到偏铝酸HA1O2,若产生AlO2-的话,则CO32-变成HCO3-,这就变成了弱酸制强酸;
C.根据酸性越强,电离常数越大;
D.酸性:HCO3->HA1O2,根据强酸制弱酸,HCO3-与A1O2-会发生反应.
解答:解:A.由强酸制弱酸,通入CO2于AlO2-溶液中,先生成氢氧化铝和碳酸钠,CO2过量能与碳酸钠反应生成碳酸氢钠,所以溶液中有HCO3-生成,故A错误;
B.酸性:HCO3->HA1O2,Al(OH)3即H3AlO3失一个水,得到偏铝酸HA1O2,若产生AlO2-的话,则CO32-变成HCO3-,不符合强酸制弱酸,故B错误;
C.酸性:HCO3->HA1O2,则Al(OH)3的酸式电离常数比HCO3-的电离常数小,故C错误;
D.酸性:HCO3->HA1O2,根据强酸制弱酸,HCO3-与A1O2-会发生反应,所以在水溶液中HCO3-不能与AlO2-大量共存,故D正确;
故选D.
B.酸性:HCO3->HA1O2,Al(OH)3即H3AlO3失一个水,得到偏铝酸HA1O2,若产生AlO2-的话,则CO32-变成HCO3-,不符合强酸制弱酸,故B错误;
C.酸性:HCO3->HA1O2,则Al(OH)3的酸式电离常数比HCO3-的电离常数小,故C错误;
D.酸性:HCO3->HA1O2,根据强酸制弱酸,HCO3-与A1O2-会发生反应,所以在水溶液中HCO3-不能与AlO2-大量共存,故D正确;
故选D.
点评:本题主要考查了强酸制弱酸以及酸性的比较,难度不大,抓住原理即可解决.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
 I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题:
I.常温下在20mL0.1mol?L-1Na2CO3溶液中逐滴加入0.1mol?L-1 HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.回答下列问题: H++HA- HA-
H++HA- HA- H++A2-
H++A2-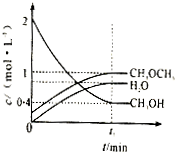 Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是
Ⅰ.(1)利用水煤气合成二甲醚(CH3OCH3)的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是