题目内容
下列说法正确的是( )
| A、在化学反应中,发生物质变化的同时不一定发生能量变化 |
| B、反应:MgCO3(s)═MgO(s)+CO2(g),在高温下不能自发进行 |
| C、HR溶液导电性较弱,则HR属于弱电解质 |
| D、反应产物的总焓大于反应物的总焓时,△H>0 |
考点:强电解质和弱电解质的概念,反应热和焓变
专题:
分析:A.化学反应的本质是旧键断裂,新键生成,反应一定伴随能量变化;
B.碳酸镁分解属于吸热反应,△H>0,MgCO3(s)═CaO(s)+CO2(g),固体分解得到气体,混乱度增加,△S>0,根据△G=△H-T?△S<0自发判断;
C.电解质溶液导电能力与自由移动的离子浓度成正比;
D.反应的焓变=生成物的总焓-反应物的总焓计算;
B.碳酸镁分解属于吸热反应,△H>0,MgCO3(s)═CaO(s)+CO2(g),固体分解得到气体,混乱度增加,△S>0,根据△G=△H-T?△S<0自发判断;
C.电解质溶液导电能力与自由移动的离子浓度成正比;
D.反应的焓变=生成物的总焓-反应物的总焓计算;
解答:
解:A.化学反应的本质是旧键断裂,新键生成,在化学反应过程中,发生物质变化的同时一定发生能量变化,故A错误;
B.碳酸镁分解属于吸热反应,△H>0,MgCO3(s)═MgO(s)+CO2(g),固体分解得到气体,混乱度增加,△S>0,在高温条件下△G=△H-T?△S<0反应自发进行,故B错误;
C.电解质溶液导电能力与自由移动的离子浓度成正比,HR可能为强电解质,当电解质溶液的离子浓度较小时,溶液导电性较弱,故C错误;
D.反应的焓变=生成物的总焓-反应物的总焓计算,反应产物的总焓大于反应物的总焓时,△H>0,故D正确;
故选D.
B.碳酸镁分解属于吸热反应,△H>0,MgCO3(s)═MgO(s)+CO2(g),固体分解得到气体,混乱度增加,△S>0,在高温条件下△G=△H-T?△S<0反应自发进行,故B错误;
C.电解质溶液导电能力与自由移动的离子浓度成正比,HR可能为强电解质,当电解质溶液的离子浓度较小时,溶液导电性较弱,故C错误;
D.反应的焓变=生成物的总焓-反应物的总焓计算,反应产物的总焓大于反应物的总焓时,△H>0,故D正确;
故选D.
点评:本题考查了化学反应的实质、反应自发进行的判断依据应用,注意对基础知识的理解掌握,B选项注意根据化学方程式准确判断出焓变和熵变,然后根据△G=△H-T?△S<0自发判断温度,题目难度中等.

练习册系列答案
相关题目
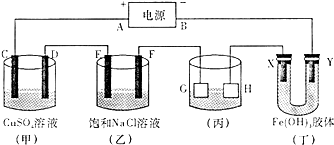 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,装置(丁)中Y极附近红褐色变深,则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,装置(丁)中Y极附近红褐色变深,则以下说法正确的是( )| A、电源B端是正极 |
| B、(甲)装置的C、D电极均有单质生成,且其物质的量之比为2:1 |
| C、欲用(丙)装置给铜镀银,H应该是银,电镀液是硝酸银溶液 |
| D、若向(乙)中滴入酚酞溶液,在F极附近先出现红色 |
当航天飞机返回地球进入大气层时,由于空气的剧烈摩擦,航天飞机尖端的温度超过1000℃.为防止高温将其烧毁,科学家给航天飞机相应部位设计安装了可靠的保护层.制作保护层的材料可能为( )
| A、合成塑料 | B、新型陶瓷 |
| C、镁铝合金 | D、不锈钢 |
将15.6gNa2O2和5.4gAl时放入一定量的水中,充分反应后得到200mL澄清溶液,再向该溶液中缓慢通入标准况下的HCl气体6.72L,若反应过程中溶液的体积保持不变( )
| A、最终得到7.8g的沉淀 |
| B、最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
| C、反应过程中得到6.72L的气体(标准状况下) |
| D、最终得到的溶液中c(NaCl)=2mol/L |
下列物质属于电解质的是( )
| A、Cu |
| B、CO2 |
| C、KNO3 |
| D、乙醇 |
下列有关物理量相应的单位表达中,错误的是( )
| A、摩尔质量g/mol |
| B、气体摩尔体积mol/L |
| C、溶解度g |
| D、密度g/cm3 |
晚自习的课间,同学们站在学校4楼上,可以看到在容桂街道的空中有移动的光柱,这就是气溶胶中发生的丁达尔现象,下列分散系不能发生丁达尔现象的( )
| A、豆浆 |
| B、Fe(OH)3胶体 |
| C、食盐水 |
| D、烟、云、雾 |