题目内容
(10分)黄铁矿(主要成分为FeS2)曾是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
I.将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O22Fe2O3+8SO2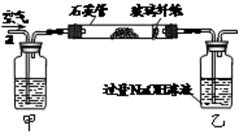
II.反应结束后,将乙瓶中的溶液进行如下图所示处理。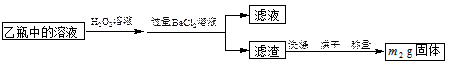
[实验二]测定铁元素的含量。
III.测定铁元素的含量的实验步骤如下图所示。
问题讨论:
(1)上述装置中,甲瓶内所盛试剂是 溶液。
(2)向乙瓶溶液中滴加H2O2溶液时,发生氧化还原反应的离子方程式为 。
II中除了可以用H2O2溶液作为氧化剂,还可以加入 (填序号)。
①氯水 ②浓H2SO4 ③HNO3 ④Fe2(SO4)3
(3)该黄铁矿中硫元素的质量分数为 。
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?并说明理由。(如合理,则此空不填) (填“合理“或”不合理“)、 (如合理,则此空不填)。
(5)若要测定铁元素的含量,则步骤III中还需要测定的数据有 。
(1)NaOH(或KOH)(1分)
(2)SO32-+H2O2=SO42-+H2O(2分) ①③(2分)
(3) (2分)
(2分)
(4)不合理(1分),铁粉会与Fe2 (SO4)3和H2SO4反应生成Fe2+,使所测得铁元素的质量分数偏大(1分)
(5)④中所消耗酸性KMnO4溶液的体积(1分)
解析

| |||||||||||||||||||
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:

查资料得知:
|
物质名称 |
溶度积(Ksp) |
pH值 |
|
|
开始沉淀 |
完全沉淀 |
||
|
Mg(OH)2 |
5.6×10-12 |
9.3 |
10.8 |
|
Fe(OH)3 |
2.8×10-16 |
2.7 |
3.7 |
|
Al(OH)3 |
1.3×10-33 |
3.7 |
4.7 |
请回答下列问题:
(1)写出固体A的化学式为 。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G 。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为 。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。