题目内容
12.(1)25℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0mL,测得pH=11,则该条件下,NH3•H2O的电离平衡常数为10-5.向此溶液中加入少量的氯化铵固体,此时$\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$ 值将增大(填“增大”,“减小”或“不变”).(2)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当pH=4时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
分析 (1)根据氨水电离生成等量的铵根离子和氢氧根离子,求出平衡时各离子的浓度,在利用电离平衡常数的表达式计算出NH3•H2O的电离平衡常数;
(2)根据Ksp[Al(OH)3]=1.0×10-33求出氢氧根离子浓度.
解答 解:(1)氨水溶液PH=11,则c(H+)═10-11 mol•L-1,c(0H-)═10-3mol•L-1,
NH3•H2O?NH4++OH-
起始(mol•L-1) 0.1 0 0
反应(mol•L-1)-)10-3 10-3 10-3
平衡(mol•L-1) 0.1 10-3 10-3
NH3•H2O的电离平衡常数为:$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=1.0×10-5;
向此溶液中加入少量的氯化铵固体,溶液中铵离子浓度增大,氨水的电离程度减小,所以氢氧根离子浓度减小,此时$\frac{c(N{{H}_{4}}^{+})}{c(O{H}^{-})}$值将增大,
故答案为:10-5; 增大;
(2)0.001mol/LAlCl3溶液中铝离子浓度为0.001mol/L,带人Ksp[Al(OH)3]=c(Al3+)×[c(OH-)]3可得:c(OH-)=1.0×10-10mol/L,常温下,氢离子浓度为:1.0×10-4mol/L,溶液pH=4,
故答案为:4.
点评 本题考查了弱电解质电离平衡、化学平衡常数、溶度积常数的计算等知识,题目难度中等,试题涉及的知识点较多,注意掌握电离平衡常数和溶度积常数的计算方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列变化过程,属于放热反应的是( )
①铁生锈②碳酸钙高温分解③固体氢氧化钠溶于水④H2在Cl2中燃烧⑤浓硫酸稀释⑥酸碱中和反应.
①铁生锈②碳酸钙高温分解③固体氢氧化钠溶于水④H2在Cl2中燃烧⑤浓硫酸稀释⑥酸碱中和反应.
| A. | ①②④ | B. | ①④⑥ | C. | ①③④⑤⑥ | D. | ⑤⑥ |
3.下列各项化学用语中表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | CH4分子的比例模型 | ||
| C. | 硫离子的结构示意图: | D. | 氮气的电子式  |
20.X、Y、Z、W为四种短周期元素,它们在周期表中的位置关系如图所示.Z元素的最外层电子数等于其电子层数.下列说法中正确的是( )
| X | |||
| Z | W | Y |
| A. | Y的气态氢化物比X的氢化物沸点低 | |
| B. | Z元素的氧化物属于碱性氧化物 | |
| C. | 原子半径由小到大的顺序为:X<Z<Y<W | |
| D. | Y元素最高价氧化物对应的水化物化学式为H3YO4 |
7.有关化学用语正确的是( )
| A. | 乙烯的结构式C2H4 | B. | 正丁烷的结构简式CH3CH2CH2CH3 | ||
| C. | 四氯化碳的电子式 | D. | 苯的分子式 |
17.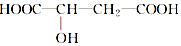 苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等药效的健康食品.苹果酸(2羟基丁二酸)是这种饮料的主要成分,苹果酸的结构简式如图所示.下列说法不正确的是( )
苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等药效的健康食品.苹果酸(2羟基丁二酸)是这种饮料的主要成分,苹果酸的结构简式如图所示.下列说法不正确的是( )
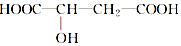 苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等药效的健康食品.苹果酸(2羟基丁二酸)是这种饮料的主要成分,苹果酸的结构简式如图所示.下列说法不正确的是( )
苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等药效的健康食品.苹果酸(2羟基丁二酸)是这种饮料的主要成分,苹果酸的结构简式如图所示.下列说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 1 mol苹果酸与足量Na反应生成33.6 L H2(标准状况下) | |
| D. | 1 mol苹果酸与过量的Na2CO3溶液反应可生成1molCO2 |
4.氰气[(CN)2]和氰化物都是剧毒性物质,氰分子的结构式为N≡C-C≡N,性质与卤素相似,下列叙述错误的是( )
| A. | 氰分子中四原子共直线,是非极性分子 | |
| B. | 氰分子中C≡N键长大于C≡C键长 | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰化氢在一定条件下能与烯烃发生加成反应 |

 为该转化过程的催化剂
为该转化过程的催化剂