题目内容
15.X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构,下列说法正确的是( )| A. | 原子最外层电子数:Z>Y>X | B. | 单质熔点:Y>Z>X | ||
| C. | 离子半径:X2->Z->Y+ | D. | 原子序数:X>Z>Y |
分析 X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素,结合元素在周期表中的位置以及元素周期律知识解答该题.
解答 解:由上述分析可知,X为S,Y为Na,Z为F,
A.X、Y、Z分别为S、Na、F,原子最外层电子数分别为6、1、7,即原子最外层电子数:Z>X>Y,故A错误;
B.常温下Na、S为固体,F2为气体,Na的熔点较低,但钠的沸点高于硫,熔点应为Na>S>F2,故B错误;
C.Na+、F-具有相同的核外电子排布,离子的核电荷数越大,半径越小,应为F->Na+,S2-电子层最多,离子半径最大,故离子半径S2->F->Na+,故C正确;
D.S的原子序数为16,Na的原子序数为11,F的原子序数为9,则原子序数:X>Y>Z,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
14. 设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )
设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )
 设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )
设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )| A. | 水、氯化氢 | B. | 稀硫酸、氨气 | ||
| C. | 氢氧化钠溶液、SO2 | D. | 氢氧化钠溶液、CO |
6.下列图示实验操作,能达到目的是( )
| A. |  检验K+的存在 检验K+的存在 | B. | 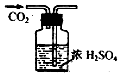 干燥CO2 | C. |  分离酒精与水 分离酒精与水 | D. |  蒸发食盐水 |
3.下列离子方程式书写正确的是( )
| A. | Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-═HClO+HSO3- | |
| D. | NaAlO2溶液和过量的HCl溶液反应:AlO2-+H++H2O═Al(OH)3↓ |
10.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定 | |
| D. | 己知2C(s)+2O2(g)═2CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)═2CO(g)△H=b kJ•mol-1,则a>b |
20.下列实验装置不能达到实验目的是( )
| A. |  用图所示装置可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  用图所示装置可降低金属铁的腐蚀速率 | |
| C. |  用图所示装置可测量强酸强碱的中和热 | |
| D. |  用图所示装置可制备Fe(OH)2并能较长时间观察其颜色 |
4. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 最高价氧化物对应水化物的酸性:X>W>Z | |
| C. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| D. | 沸点:XH3<WH3 |
