��Ŀ����
��1����ͼ����250mL����ƿ�г�������x��©����ʢ�ŵ��ǵ��з�̪��Һ���ռ���Һ���������ͨ��������״���£���©������ƿ�з�10mL��Һ������Ѹ���ʹ���Һ�ɺ�ɫ��Ϊ��ɫ����ԭ��ƿ�г�����������________���ռ���Һԭ���ʵ���Ũ�Ȳ�����________mol•L��1��

��2������ƿ�ռ������CO2����ƿ����һֻ�����ڲ�����ĩ�˵�С������ͼ��ʾ��

�ٴ�ƿ����Ѹ�ٷֱ�����������ʣ�����������һ��ʱ���������Զ����͵���________������ţ���
A��Na2O �������������������� B��Na2O2
C��Na2CO2 �������������������� D��NaOH
������ƿ��װ��10mLH2O��������CO2������һ�����Ľ����ƺ�Ѹ������ƿ�����Ը���������״�ı仯����������Һ�����ʵĿ�����ɡ�
������
��1��HCl����HBr��HI�� 1��12 ��2����ABD ��n��Na����n��CO2����2��1��Na2CO3��NaOH�� n��Na����n��CO2����2��1��Na2CO3�� 1��1��n��Na����n��CO2����2��1��Na2CO3��NaHCO3�� n��Na����n��CO2����1��1��NaHCO3�� n��Na����n��CO2����1��1��NaHCO3��
|

 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д���14�֣���ҵ��һ���ں����ܱ������п��Բ������з�Ӧ�ϳɼ״���
��1���жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ���ͬ��__________��
A. ����������������
���������
B. ���������ܶȲ���
C. �����������ƽ��������������
D. ��
��
��Ũ�ȶ����ٷ����仯
E. �����ѹǿ���ٸı�
��2���±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
���ɱ��������жϸ÷�Ӧ�ġ�H__________0���>������=����<������
��ij�¶��£�����
����
���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���
����CO��ת����Ϊ__________����ʱ���¶�Ϊ__________��
��3��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��__________��
a. ���� b. ������� c.����CO��Ũ��
d. �����¼��� ʹѹǿ��� e. �����¼����������ʹѹǿ��� f. ������״�
��4����250��ʱ��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ���Ũ�ȼ��±�:
| CO | | |
| 0.5 mol��L��1 | 2mol��L��1 | 6mol��L��1 |
��ʱ��Ӧ�������淴Ӧ���ʵĹ�ϵ�ǣ�v������ v���棩������ڡ���С�ڡ����ڡ�����
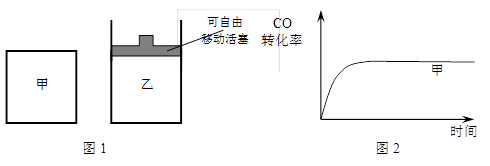
��5����ͼ1��ʾ����Ϊ�����ܱ���������Ϊ��ѹ�ܱ��������ڼס����������зֱ��������ʵ�����H2��CO��ʹ�ס�����������ʼ�ݻ���ȡ�����ͬ�¶��·���������Ӧ����ά�ַ�Ӧ�������¶Ȳ��䡣��֪��������CO��ת������ʱ��仯��ͼ����ͼ2��ʾ������ͼ2�л�����������CO��ת������ʱ��仯��ͼ��
��ҵ��һ���ں����ܱ������п��Բ������з�Ӧ�ϳɼ״���
CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
��1���жϷ�Ӧ�ﵽƽ��״̬�������ǣ�����ĸ��ţ���ͬ��__________��
A������CH3OH������������CO���������
B�����������ܶȲ���
C�������������ƽ��������������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
E. �����������ѹǿ���ٸı�
��2���±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
|
�¶� |
250�� |
300�� |
350�� |
|
K |
2.041 |
0.270 |
0.012 |
���ɱ��������жϸ÷�Ӧ�ġ�H__________0���>������="��" ��<������
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c(CO) =" 0.2" mol/L����CO��ת����Ϊ__________����ʱ���¶�Ϊ__________��
��3��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��__________��
a. ���� b. �������
c. ����CO��Ũ�� d. �����¼���H2ʹ������ѹǿ���
e. ������״� f. �����¼����������ʹ������ѹǿ���
��4����250��ʱ��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ���Ũ�ȼ��±�:
|
CO |
H2 |
CH3OH |
|
0.5 mol��L-1 |
2mol��L-1 |
6mol��L-1 |
��ʱ��Ӧ�������淴Ӧ���ʵĹ�ϵ�ǣ�v������ v���棩���>������="��" ��<������
��5����ͼ1��ʾ����Ϊ�����ܱ���������Ϊ��ѹ�ܱ��������ڼס����������зֱ��������ʵ�����H2��CO��ʹ�ס�����������ʼ�ݻ���ȡ�����ͬ�¶��·���������Ӧ����ά�ַ�Ӧ�������¶Ȳ��䡣��ͼ2�б���ס�����������CO��ת������ʱ��仯�Ķ�Ӧͼ��(��ͼ����Ӧ�����Ҳ�Ŀ���зֱ��ע���ס������ҡ�)��