题目内容
|
一定条件下某混合气体由两种气态烃组成.2.24 L该混合气体完全燃烧后,得到4.48 L二氧化碳(气体已折算成标准状况)和4.5 g水.则这两种气体可能是 | |
A. |
CH4和C3H8 |
B. |
CH4和C5H8 |
C. |
C2H4和C3H4 |
D. |
C2H4和C2H6 |

 名校课堂系列答案
名校课堂系列答案在800℃时,在2L密闭容器中将一定量的NO和O2混合发生反应
![]() ,n(NO)随时间的变化如下表:
,n(NO)随时间的变化如下表:
| 时间/s | 0 | 10 | 20 | 30 | 40 | 50 |
| n(NO)/mol | 0.2 | 0.1 | 0.08 | 0.07 | 0.07 | 0.07 |
请回答下列问题:
(1)用O2表示从0~20s内该反应的速率为 ;达到平衡时NO的转化率为 。
(2)若升温到850℃,平衡后n(NO)= n(NO2),则该反应是 热反应(填:“吸”、“放”)
(3)下列能说明该反应已达到平衡的是 。
A.容器内压强不变 B.容器内气体密度不变
C.n(NO)= n(NO2) D.容器内气体颜色不变
E.容器内混合气体的平均分子量不变 F.v(NO2)=2v(O2)
(4)若改变某一条件,达新平衡时n(NO)= 0.06 mol,下列说法正确的是 。
A.平衡一定正向移动
B.可能是向容器中加入了一定量的NO气体
C.NO的转化率一定增大
D.可能是缩小了容器的体积
(5)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,写出在此条件下该反应的热化学方程式 。
(14分,每空2分)
I.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 2NH3(g) △H= -92.4 kJ/mol 据此回答以下问题:
(1)为了提高氨气的产率,可以选择的方法是 _______ (填序号,错选扣分)。
① 升高温度 ② 增大压强 ③ 使用催化剂 ④ 及时分离出NH3
(2)对在密闭容器中进行的可逆反应:N2(g)+3H2(g)2NH3(g),下列哪种情况下,
说明该反应已经达到化学平衡状态____________________________________。
①N2的正反应速率是NH3的逆反应速率的1/2
②在恒容条件下,混合气体的压强保持不变
③N2、H2、NH3的物质的量之比为1:3:2
④单位时间内每生成3mol H2的同时有2mol NH3生成
⑤3mol N-N键断裂,同时有6mol N-H键断裂
(3)一定条件下,NH3在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是________________(选填序号)。
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入NH3的物质的量 |
| y | NH3的物质的量 | 平衡常数K | NH3的转化率 | 生成物物质的量总和 |
II.(1)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
|
| 0.01mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol·L-1 Na2SO3溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | --------- |
| 实验2 | 5 | 5 | 40 | 25 | ---------- |
| 实验3 | 5 | 5 | V2 | 0 | ----------- |
该实验的目的是_______________________________________________________________
________________________________________________;
表中V1=___________mL.
(2)可逆反应C(s)+H2O(g) H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率
![]() 与时间t的关系如右图。
与时间t的关系如右图。
①图中t4到t6段时引起平衡移动的条件可能是 ;
②图中表示平衡混合物中CO的含量最高的一段时间是 。

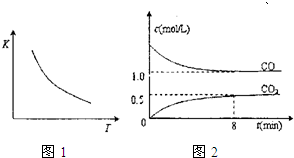 (2010?沈阳二模)一定条件下某密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g),已知该反应的平衡常数(K)的与温度(T)的关系如图1,图2是T1温度下该反应的c-t关系图象.则下列说法正确的是( )
(2010?沈阳二模)一定条件下某密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g),已知该反应的平衡常数(K)的与温度(T)的关系如图1,图2是T1温度下该反应的c-t关系图象.则下列说法正确的是( ) 2NO2(g);△H=-12.5aKJ?mol-1
2NO2(g);△H=-12.5aKJ?mol-1