题目内容
【题目】利用氧化还原反应原理配平
(1)__NH3+___O2![]() ____NO +____H2O
____NO +____H2O
(2)____FeSO4+____KNO3+____H2SO4=____K2SO4+____Fe2(SO4)3+____NO↑+____H2O
【答案】4 5 4 6 6 2 4 1 3 2 4
【解析】
(1)反应中N元素化合价由NH3中-3价升高为NO中+2价,共升高5价,O元素由O2中0价降低为-2价,共降低4价,化合价升降最小公倍数为20,故NH3系数为4,故O2系数为5,利用元素守恒配平其他物质的系数;
(2)反应中Fe元素化合价由+2价升高为+3价,2FeSO4变为Fe2(SO4)3,共升高2价;氮元素由+5价降低到+2价,共降低3价;化合价升降最小公倍数为6,故FeSO4系数为6,KNO3系数为2,利用元素守恒配平其他物质的系数。
(1)反应中N元素化合价由NH3中-3价升高为NO中+2价,共升高5价,O元素由O2中0价降低为-2价,共降低4价,化合价升降最小公倍数为20,故NH3系数为4,故O2系数为5,利用元素守恒可知NO系数为4,H2O的系数为6,故配平后方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
综上所述,本题正确答案为:4 5 4 6;
(2)反应中Fe元素化合价由+2价升高为+3价,2FeSO4变为Fe2(SO4)3,共升高2价;氮元素由+5价降低到+2价,共降低3价;化合价升降最小公倍数为6,故FeSO4系数为6,KNO3系数为2,利用元素守恒可知NO的系数为2,Fe2(SO4)3的系数为3,K2SO4的系数为1,H2SO4的系数为4,H2O的系数为4,故配平后方程式为6FeSO4+2KNO3+4H2SO4=K2SO4+3Fe2(SO4)3+2NO↑+4H2O;
综上所述,本题正确答案: 6 2 4 1 3 2 4。

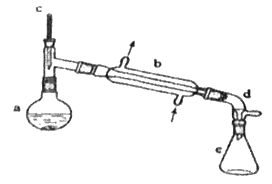
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
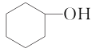
![]()
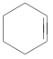 +H2O
+H2O
可能用到的有关数据如下:
相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
Ⅰ.合成反应:在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口倒出”)。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
【题目】如图是一套检验气体性质的实验装置。请回答下列问题。
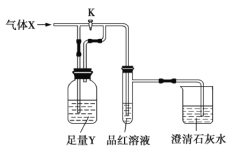
A | B | C | D | |
X | 氯气 | 二氧化硫 | 二氧化碳 | 氯化氢 |
Y | Na2SO3溶液 | 饱和NaHCO3溶液 | Na2SO3溶液 | 饱和NaHSO3溶液 |
(1)向装置中缓缓通入少量气体X,若关闭活塞K,则品红溶液褪色。据此判断气体![]() 和洗气瓶内的溶液Y可能的组合是_________(填表中序号,下同)。
和洗气瓶内的溶液Y可能的组合是_________(填表中序号,下同)。
(2)若打开活塞K,品红溶液褪色,同时澄清石灰水变浑浊,则气体X和洗气瓶内液体Y可能的组合是______