题目内容
 按照题目的要求,回答下列有关题:
按照题目的要求,回答下列有关题:一定条件下,体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)△H<0达到化学平衡状态.
(1)该反应的平衡常数表达式K=
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是
(3)判断该可逆反应达到化学平衡状态的标志是
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变 c.CO、H2、CH3OH的浓度均不再变化 d.混合气体的压强不再改变
(4)用Pt做电极把甲醇设计成酸性燃料电池,则甲醇通入的一极是
考点:化学平衡的影响因素,化学电源新型电池,化学平衡常数的含义
专题:化学平衡专题,电化学专题
分析:(1)化学平衡常数表达式中不要用s、l状态的物质;从平衡移动角度结合K表达式分析;
(2)用v=
求算;
(3)判断平衡的关键有两点:v(正)=v(逆)和各物质的浓度保持不变,依次分析;
(4)电池中,正极发生还原反应,负极发生氧化反应;电极反应式:总反应方程式减去一极等于另一极.
(2)用v=
| △c |
| △t |
(3)判断平衡的关键有两点:v(正)=v(逆)和各物质的浓度保持不变,依次分析;
(4)电池中,正极发生还原反应,负极发生氧化反应;电极反应式:总反应方程式减去一极等于另一极.
解答:
解:(1)CO(g)+2H2(g)?CH3OH(g)的K=
;因其△H<0,升温时平衡逆向移动,K减小;K只受温度的影响,压强增大时,K不变.
故答案为:K=
;减小;不变;
(2)v(H2)=
=
=
mol/(L?min),故答案为:
;
(3)化学平衡状态判断的关键:v(正)=v(逆)和各物质的浓度保持不变.
a、v生成(CH3OH)和v消耗(CO)都是正向进行,无法体现v(正)=v(逆),故a错误;
b、V是3L不变,反应物和生成物都是气体,混合气体总质量m不变,所以ρ时刻保持不变,b错误;
c、物质的浓度保持不变说明反应已达平衡状态,c正确;
d、V不变,反应物有3mol气体时完全反应后应生成1mol气体,气体体积减小,故压强不变时说明反应已达平衡状态,d正确.
故答案为:cd;
(4)甲醇发生氧化反应,氧气发生还原反应,所以,甲醇应在负极反应;
总反应方程式为 2CH4O+3O2=2CO2+4H2O ①
O2一极的电极方程式为 3O2+12e-+12H+=6H2O ②
甲醇电极反应方程式为①-②得:2CH4O-12e-+2H2O═2CO2+12H+
故答案为:负极;2CH4O-12e-+2H2O═2CO2+12H+.
| c(CH3OH) |
| c(CO)×c2(H2) |
故答案为:K=
| c(CH3OH) |
| c(CO)×c2(H2) |
(2)v(H2)=
| △c(H2) |
| △t |
| ||
| tB |
| nB |
| 3tB |
| nB |
| 3tB |
(3)化学平衡状态判断的关键:v(正)=v(逆)和各物质的浓度保持不变.
a、v生成(CH3OH)和v消耗(CO)都是正向进行,无法体现v(正)=v(逆),故a错误;
b、V是3L不变,反应物和生成物都是气体,混合气体总质量m不变,所以ρ时刻保持不变,b错误;
c、物质的浓度保持不变说明反应已达平衡状态,c正确;
d、V不变,反应物有3mol气体时完全反应后应生成1mol气体,气体体积减小,故压强不变时说明反应已达平衡状态,d正确.
故答案为:cd;
(4)甲醇发生氧化反应,氧气发生还原反应,所以,甲醇应在负极反应;
总反应方程式为 2CH4O+3O2=2CO2+4H2O ①
O2一极的电极方程式为 3O2+12e-+12H+=6H2O ②
甲醇电极反应方程式为①-②得:2CH4O-12e-+2H2O═2CO2+12H+
故答案为:负极;2CH4O-12e-+2H2O═2CO2+12H+.
点评:本题考查化学平衡常数表达式及其应用,化学反应速率的求算以及化学平衡状态的判定和燃料电池.考查范围广,内容跨度大,符合高考要求.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
请用下列装置进行下列实验,可以达到实验目的是( )
A、 定量测定化学反应速率 |
B、 验证钠与水反映的热效应 |
C、 加热d即可进行乙醇的催化氧化实验 |
D、 比较Fe3+和Cu2+对H2O2分解的催化效果 |
下列叙述是某同学做完铜一锌一硫酸原电池的实验后得出的结论和认识,你认为正确的是( )
| A、构成原电池正极和负极的材料必须是两种金属 |
| B、在该原电池中,铜作负极 |
| C、铜锌原电池工作时,若有13g锌溶解,则电路中就有0.4mol电子通过 |
| D、电子通过硫酸溶液由锌流向铜,在铜电极上被氢离子得到而放出氢气 |
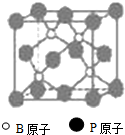 (物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.
(物质结构与性质)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr. (1)北京奥运会的“祥云”火炬所用燃料主要是丙烷,若以硫酸溶液为电解质溶液,两极分别通入丙烷和空气,形成燃料电池,则反应总方程式为
(1)北京奥运会的“祥云”火炬所用燃料主要是丙烷,若以硫酸溶液为电解质溶液,两极分别通入丙烷和空气,形成燃料电池,则反应总方程式为